Масляная
кислота (бутират), н-бутанол, ацетон, 2-пропанол и ряд других органических
кислот и спиртов являются типичными продуктами сбраживания углеводов
анаэробными спорообразующими бактериями (клостридиями). Поэтому клостридии, а
также некоторые специализированные виды, сбраживающие только этанол,
аминокислоты или иные вещества, рассматриваются здесь в связи с маслянокислым
брожением, которое они вызывают.
Признаки. Род Clostridium относится
к семейству Васillасеае.
Как и другие представители этого семейства(Bacillus, Sporolactobacillus, De-sulfotomaculum и Sporosarcina), клостридии
грам-положительны. Благодаря перитрихально расположенным жгутикам они очень
подвижны. Вегетативные клетки палочковидные, однако форма их может изменяться в
зависимости от условий среды. Овальные или шарообразные эндоспоры изменяют
форму палочковидной материнской клетки, так как их диаметр, как правило, больше
толщины этой клетки. Споры терморезистентны.
Физиологически
клостридии отличаются резко выраженным бродильным типом
метаболизма, а также чувствительностью к кислороду: они растут только в анаэробных условиях.
Однако существуют, по-видимому, все переходные формы - от строго анаэробных видов (Clostridium pasteurianum,
С. kluyveri) до почти аэротолерантных (например, С. histolyticum,
С. acetobutylicum). Клостридии, как правило, не содержат гемопротеинов
(цитохромов, каталазы). Некоторые виды способны, однако, образовывать
цитохромы, если в питательной среде содержатся их предшественники. Из запасных
веществ широко распространены крахмалоподобные полисахариды.
Температурный
оптимум для роста большинства известных видов Clostridium лежит
между 30 и 40°С Наряду с этими мезофильными представителями встречается много
термофильных видов с оптимумом 60-75°С, таких как С. thermoaceticum и
С. thermohydrosulfuricum. Подобно другим представителям
Bacillaceae, клостридии способны расти только при нейтральной (или щелочной)
реакции среды. Поэтому их рост, часто нежелательный, может быть полностью
подавлен при подкислении (например, в квашеной капусте, силосе, фруктовых
консервах, сырых колбасах).
Субстраты. Клостридии
весьма сильно различаются в отношении субстратов, которые они могут
использовать и сбраживать. Некоторые виды мало разборчивы и используют широкий
круг веществ, другие узко специализированы и способны сбраживать лишь один или
несколько субстратов. В целом же клостридиям доступно множество различных
природных соединений. Они способны разлагать полисахариды (крах мал, гликоген,
целлюлозу, гемицеллюлозы, пектины), нуклеиновые кис лоты, белки, аминокислоты,
пурины и пиримидины. Одним клостри диям нужны сложные питательные среды или
ростовые вещества, другие в них не нуждаются. Некоторые могут обходиться молеку
лярным азотом как единственным источником этого элемента; азот они связывают с
большой скоростью (Clostridium pasteurianum).
По
способности использовать различные субстраты клостридии можно подразделить на
ряд групп. Сахаролитические клостридии расщепляют преимущественно
полисахариды или сахара. Пептолитическиеклостридии расщепляют
белки, пептоны и аминокислоты. Группы в свою очередь объединяют на основе типов
брожения и его продуктов (табл. 8.7 и 8.8). 
Для получения
накопительных культур видов Clostridium можно воспользоваться
некоторыми их особенностями. Поскольку их споры тер морезистентны, инокулят
предварительно пастеризуют. Создавая строго анаэробные условия, заранее
исключают рост всех аэробных бактерий. Так как некоторые бактерии, расщепляющие
полисахариды, прикреплены к поверхности частиц, например к крахмальным зернам
или к частицам целлюлозы в рубце жвачных или каких-то осадках, эти частицы
можно сначала промыть, чтобы освободить их от других бактерий, а затем
использовать как материал для инокуляции. Для поддержания способности к
интенсивному брожению нужно и в последующей работе с выделенными штаммами
всегда пользоваться пастеризованными инокулятами.
Биохимия
брожения и его продукты. При брожении образуются в разных соотношениях
кислоты (масляная, уксусная, молочная), спирты (бутанол, этанол, 2-пропанол), а
также ацетон и газообразные продукты (Н2 и С02).
Клостридии расщепляют глюкозу по фруктозобисфосфатному пути. Водород,
освобождающийся при дегидрировании глицеральдегидфосфата, переносится, как
правило, на органические кислоты или кетоны, образуемые из пирувата или
ацетил-СоА. Прототипом брожения, осуществляемого клостридиями, можно считать
сбраживание глюкозы Clostridium butyricum и С.acetobutylicum; при
этом образуются бутират, ацетат, бутанол, этанол, ацетон, 2-пропанол, С02 и
Н2. Выход продуктов варьирует в зависимости от условий. 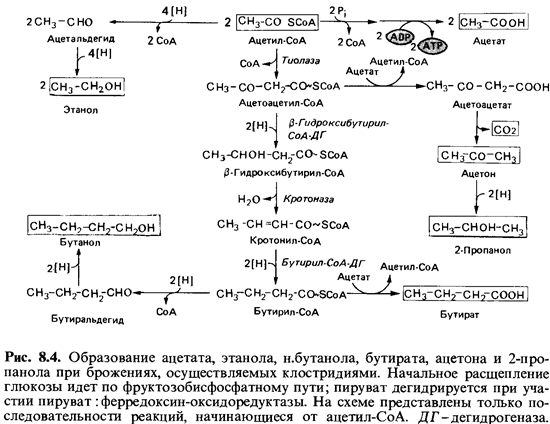
Масляная
кислота (бутират)-продукт конденсации двух молекул ацетил-СоА при участии
тиолазы с образованием ацетоацетил-СоА и его последующим восстановлением (рис.
8.4). Ацетоацетил-СоА восстанавливается за счет NADH2 при
участии fi-гидроксибутирил-СоА-дегидро- геназы до
(3-гидроксибутирил-СоА. От последнего с помощью крото-назы отщепляется
вода. Кротонил-СоА под действием флавинового фермента бутирил-СоА-дегидрогеназы восстанавливается
до бутирил-СоА. От бутирил-СоА с помощью СоА-трансферазы СоА
может пере носиться на ацетат; при этом освобождается масляная кислота, которая
выходит в среду. Из ацетил-СоА при участии фосфотрансацетилазы иацетаткиназы может
быть получен свободный ацетат, что сопрово ждается синтезом АТР из ADP.
При чистом маслянокислом брожении
образующийся при окислении пирувата водород выделяется в газообразном виде.
Когда глюкоза сбраживается согласно уравнению
Глюкоза -у Бутират
+ 2С02 + 2Н2
баланс водорода сходится; на один моль
глюкозы образуются три мо ля АТР. 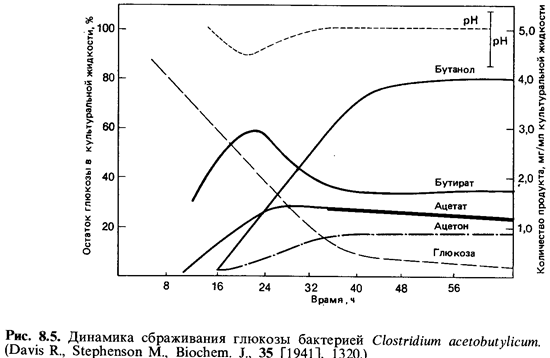
Бутанол, бутират, ацетон и 2-пропанол
образуются при сбраживании глюкозы клетками Clostridiumacetobutylicum. При
этом вначале выде ляется также масляная кислота; однако по мере подкисления
среды (рис. 8.5) начинают синтезироваться ферменты (в том числе
ацетоаце-татдекарбоксилаза), действие которых приводит к накоплению ацетона и
бутанола. Процессы образования этих веществ тесно связаны между собой. В
результате декарбоксилирования части ацетоацетата утрачи вается потенциальный
акцептор водорода, который при восстановлении в бутират мог бы дважды
присоединить 2[Н]. Этот водород так или иначе должен быть передан другим
акцепторам, в том числе и только что образовавшемуся бутирату. Для
восстановления до бутанола бути рат должен быть сначала активирован путем
превращения в бутирил-СоА. Реакции, происходящие при образовании бутирата,
ацетона и бу танола, представлены на рис. 8.4. При брожении в щелочной среде
(например, в присутствии СаСОэ; табл. 8.9) С. acetobutylicum ведет
себя как С. butyricum. Некоторые штаммы восстанавливают ацетон
и выде ляют 2-пропанол. 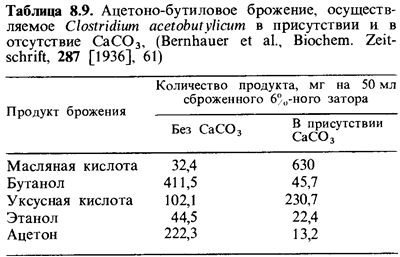
Этанол образуется в результате восстановления
ацетил-СоА.
Молекулярный водород может происходить из NADH2,
образующе гося как при расщеплении пирувата, так и при дегидрировании
глице-ральдегидфосфата. Чем больше водорода может быть образовано при этом, тем
меньше нужно синтезировать акцепторов во дорода (ацетоацетил-СоА). Таким
образом, энергия связи ацетил-СоА может быть сохранена в форме АТР. Значит,
если при сбраживании глюкозы С. butyricum на один моль
глюкозы образуется больше двух молей Н2 и поэтому меньше
бутирата и соответственно больше ацета та, то выход АТР может превышать 3 моля
(см. ниже о Ruminococcus).
Поскольку ацетон, 2-пропанол и бутанол
служат важными органиче скими растворителями, брожение, осуществляемое
клостридиями, имеет большое техническое значение. Именно в связи с получением
этих ве ществ перед промышленносью впервые встала задача проведения ми
кробиологических синтезов в условиях, исключающих возможность вся кого
загрязнения.
Сбраживание этанола и ацетата. Из накопительных культур Methanobacterium omelianskii, содержавших
в качестве субстрата этанол, была выделена анаэробная спорообразующая бактерия,
которая наряду с этанолом нуждается и в ацетате. Эта бактерия -Clostridium кluyveri-превращает
смесь уксусной кислоты и этанола в масляную и капроновую кислоты и молекулярный
водород (рис. 8.6). Ацетат слу жит дополнительным акцептором водорода, и он
образуется в ходе брожения. АТР
синтезируется только при
ацетаткиназной реакции. Сбраживание лактата и ацетата. Из накопительных культур, содержа щих в
качестве субстрата лактат, была выделена бактерия Clostridium tyrobutyricum, которой
тоже необходим ацетат как дополнительный ак цептор водорода, если главным
субстратом служит лактат или глицерол: СН3
С. tyrobutyricum сбраживает глюкозу по схеме, известной для С. butyricum, не
нуждаясь в экзогенном акцепторе водорода.
Сбраживание глутаминовой кислоты. Из множества процессов броже ния, при
которых аминокислоты в анаэробных условиях превращаются в жирные кислоты, С02 и
аммиак, мы рассмотрим только расщепление глутамата бактерией Clostridium tetanomorphum. Это
брожение цривле-кло к себе внимание потому, что на его примере была выяснена
биохи мическая функция витамина В12. С. tetanomorphum обычно
выделяют из накопительной культуры с гистидином в качестве субстрата. Гистидин
расщепляется через глутамат. При сбраживании глутамата образуются масляная и
уксусная кислоты, аммиак, С02 и молекулярный водород. Путь
катаболизма глутамата включает ряд необычных реакций (рис. 8.7). Сначала
разрываются связи между углеродными атомами 2 и 3 и образуются связи между
атомами 2 и 4, и в результате получается аминокислота- с разветвленной цепью -
метиласпарагиновая кислота. В этом участвует кофермент-производное витамина В12.
Лишь на этой стадии происходит дезаминирование. К ненасыщенной мезаконовой
(метилфумаровой) кислоте присоединяется вода, а образующаяся цитра-малевая (2-метил-яблочная)
кислота расщепляется затем на уксусную и пировиноградную кислоты. Уксусная
кислота выделяется, а пировино-градная рассмотренным выше путем превращается в
масляную кислоту и С02. 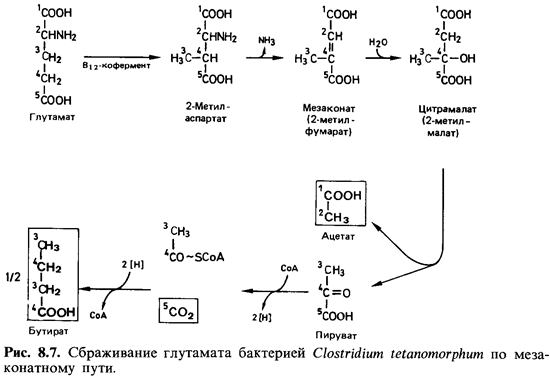
Сопряженное сбраживание двух аминокислот
(реакция Стикленда). Пептолитические
клостридии (табл. 8.7, V) гидролизуют белки и затем используют аминокислоты.
Многие аминокислоты сбраживаются толь- ко вместе с какими-нибудь другими. Как установил Стикленд (1934), Clostridium sporogenes быстро
сбраживает смесь аланина и глицина, но не может использовать ни ту ни другую из
этих аминокислот в отдель ности. Судя по суммарному уравнению
Алании + 2 Глицин +
2Н20 -► 3 Ацетат + 3NH3 + С02 аланин
служит донором водорода, а глицин-акцептором:
СН3-CHNH2-СООН
+ 2Н20 -* СН3СООН + NH3 +
+ С02 + 4[Н] 2CH2NH2-СООН
+ 4[Н] - 2СН3-СООН + 2NH3
Источником энергии, очевидно, служит сопряженная
реакция окисления-восстановления. Роль донора водорода могут
выполнять, напри мер, аланин, лейцин, изолейцин, валин, серии, метионин и т.д.
Акцепторами водорода могут служить глицин, пролин, аргинин, триптофан и т.д.
Аминокислота-донор дезаминируется в оксокислоту, которая за тем в результате
окислительного декарбоксилирования превращается в жирную кислоту. Этот этап
сопряжен с фосфорилированием и, таким образом, представляет собой реакцию,
доставляющую энергию. Водо род, перенесенный при этом на ферредоксин, снова
связывается при вос становительном дезаминировании аминокислоты-акцептора.
Однако не все аминокислоты используются всеми пептолитическими клостридия-ми.
Маслянокислое и уксуснокислое (ацетатное) брожение,
осуществляемое неспорообразующими бактериями. Некоторые роды
анаэробных бактерий близки к клостридиям по продуктам брожения; они, однако, не
образуют спор, и многие из них грам-отрицательны. Большинство таких бактерий,
образующих масляную и уксусную кислоты, было выде лено из рубца, где они
участвуют в разложении целлюлозы, крахмала и других углеводов. Они выделяют
много молекулярного водорода и СО 2 и создают метаногенным
бактериям условия для образования метана. Из бактерий рубца, образующих
масляную кислоту, следует особо упомянуть Bytyrivibrio fibrosolvens, а
из обитающих в рубце продуцентов уксусной кислоты -Ruminococcus albus. Этот
последний вид-строгий анаэроб, использующий целлюлозу и ксилан, а также многие
сахара. Он способен превращать 1 моль глюкозы в 2 моля ацетата, 2 моля С02 и
4 моля Н2-правда, при условии, что концентрация выделенного водорода
поддерживается на низком уровне. Это возможно в смешанной культуре с какой-либо
бактерией, использующей водород, например Vibriosuccinogenes (рис.
8.8). Из приведенной схемы видно, что при чистом ацетатном брожении может быть
образовано 4 моля АТР на 1 моль глюкозы. Столь высокая эффективность
регенерации АТР возможна, однако, лишь в том случае, если все возникающие при
расщеплении глюкозы восстановительные эквиваленты будут освобождаться в виде
молекулярного водорода (см. выше). 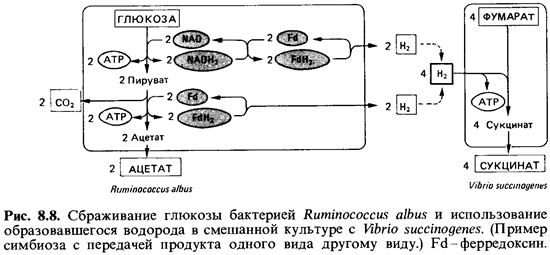
Клостридии - возбудители болезней и
продуценты токсинов. Неко
торые пептолитические клостридии могут быть возбудителями болезней при раневой
инфекции (газовая гангрена и столбняк), а также причиной пищевых отравлений.
Споры их очень распространены в почве. Если споры Clostridium histolyticum илиС. septicum попадают
в откры тую рану, к которой нет доступа воздуха или где аэробные бактерии,
потребляя кислород, создают анаэробные
условия, то эти клостридии начинают расти, расщеплять с помощью протеиназ
коллаген и другие белки, вызывать образование дурно пахнущих продуктов брожения
и газа. С такого рода газовой гангреной («госпитальной гангреной») в прежние
времена можно было бороться только путем ампутации пораженной конечности. С
раневой инфекцией связан и до сих пор еще не редко встречающийся столбняк. Его
вызывает Clostridium tetani. Эта бактерия при своем росте
выделяет очень сильный нейротоксин, вызы вающий тонические судороги мышц.
Наиболее тяжелую форму пищевого отравления - ботулизм -
вызывает Clostridium botulinum. Это широко
распространенная почвенная бактерия, которая может развиваться в недостаточно
простерилизованных мясных продуктах и бобовых консервах. Она получила свое
название потому, что встречается в колбасе (лат. botulus - колбаса). Образуемый
ею токсин в случае потребления зараженного продукта может вызвать смерть
вследствие нервного паралича, в частности паралича дыхания. Токсин этот, к
счастью, термолабилен и быстро (за 15 мин) инактивируется при кипячении.
| 






