Пути биосинтеза. Как. правило, путем ингибирования конечным продук том регулируется первый фермент данной биосинтетической последова тельности реакций. Если в клетке происходит избыточное образование и накопление конечного продукта, то в результате торможения первого фермента деятельность всей цепи тотчас же замедляется. В процессе биосинтеза изолейцина из треонина таким ферментом служит треонин-дезаминаза:
Регулируемые и нерегулируемые нефункциональные ферменты (изо-зимы). Следует отметить, что не всякая треониндезаминаза ингибирует-ся изолеицином. Если Escherichia coli растет в аэробных условиях на среде с глюкозой и солями аммония, то ее клетки содержат только од ну треониндезаминазу, на анаболическую функцию которой указывает аллостерическое торможение изолеицином. Но если клетки растут в анаэробных условиях на среде со смесью аминокислот (пептон и гид-ролизат казеина), то происходит репрессия синтеза анаболической трео-ниндезаминазы и образуется изозим, обладающий катаболической ак тивностью и подверженный аллостерическому регулированию только со стороны AMP и ADP.
Другим примером может служить образование 2-ацетиллактата в клетках Enterobacter aerogenes. Эта реакция, катализируемая синтазой ацетогидроксикислот, с одной стороны, участвует в анаэробном сбраживании глюкозы с образованием ацетоина (катаболизм); с другой сто роны, с нее начинается путь синтеза валина (анаболизм). Таким обра зом, 2-ацетиллактат является общим промежуточным продуктом разветвленной цепи реакций:
Клетки могут синтезировать два изофункциональных фермента. Один из них образуется только в том случае, если во время брожения снизи лось значение рН и конечным продуктом является нейтральный аце-тоин. Другой фермент тоже синтезируется в нейтральной и слабощелоч ной среде; он имеет высокий оптимум рН и подвержен аллостерическо му подавлению валином.
Как видно из этих примеров, взаимовлияние двух путей обмена мо жет исключаться в результате образования изозимов, активность одно го из которых обычно строго регулируется, тогда как другой не подвер гается регуляции того же типа.
Разветвленные пути биосинтеза. Особые проблемы возникают в тех случаях, когда на первый этап биосинтеза действуют два или большее число конечных продуктов. Если в какой-то гипотетической последова тельности реакций А превращается в Е, G и Н, то первый этап, А -> В, будет подавляться и в случае накопления лишь одного конечного продукта (например, Н). Однако это вызовет также снижение синтеза двух других продуктов -G и Е. Подобные проблемы, возникающие при регу-
ляции разветвленных путей биосинтеза, разные организмы, видимо, раз решили по-разному. До сих пор было найдено несколько различных ти пов регуляции для ферментов, функционирующих на расходящихся или параллельных путях метаболизма.
- 1. Первый этап катализируется несколькими изозимами, каждый из которых регулируется особым конечным продуктом.
- 2. Первый этап катализируется одним ферментом, при этом воз можны разные варианты: а) для ингибирования общего первого этапа все конечные продукты должны присутствовать в избытке; или б) каждый из конечных продуктов действует независимо от остальных (кумулятивное ингибирование), причем общее торможение может пре вышать сумму отдельных эффектов(кооперативное ингибирование).
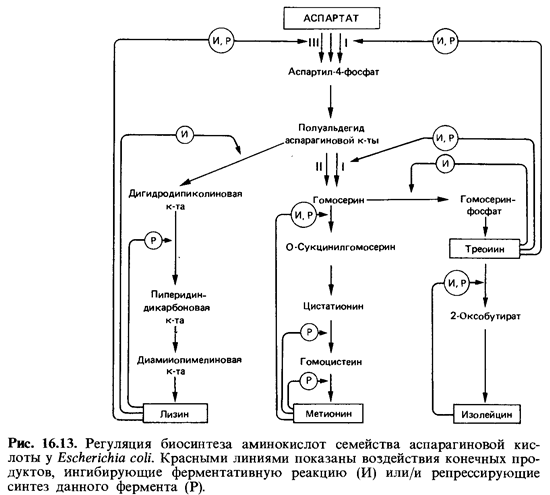
Первый этап биосинтеза аминокислот метионина, лизина, треонина и изолейцина («семейство аспарагиновой кислоты») катализируют не сколько изозимов (рис. 16.13). У Escherichia coli в реакции
Аспартат + АТР -> Аспартил-4-фосфат + ADP
участвуют три параллельно действующие аспартаткиназы, активность которых регулируется разными конечными продуктами. Аспартаткиназу I и гомосериндегидрогеназу I ингибирует треонин. АспартаткиназаIII регулируется лизином. Аспартаткиназа II не подвержена аллостериче-ской регуляции. В регуляции аспартаткиназ участвуют еще дополни тельные механизмы, причем в каждом случае первый фермент, специ фичный для данного пути биосинтеза, ингибируется конечным продук том этого пути.
Подобного рода схема регуляции существует и для «семейства аро матических аминокислот» (см. рис. 7.17). Первый этап биосинтеза фе-нилаланина, тирозина, триптофана и 4-аминобензойной кислоты со стоит в реакции эритрозо-4-фосфата с фосфоенолпируватом, в результа те которой образуется З-дезокси-О-арабиногептулозо-б-фосфат (ДАГФ). У Е. coli имеются три ДАГФ-синтазы. Одна из них контролируется тирозином, вторая - фенилаланином, а третий, малоактивный фермент не ингибируется. Дополнительная регуляция и в этом случае осуществляет ся по принципу ретроингибирования (отрицательной обратной связи).
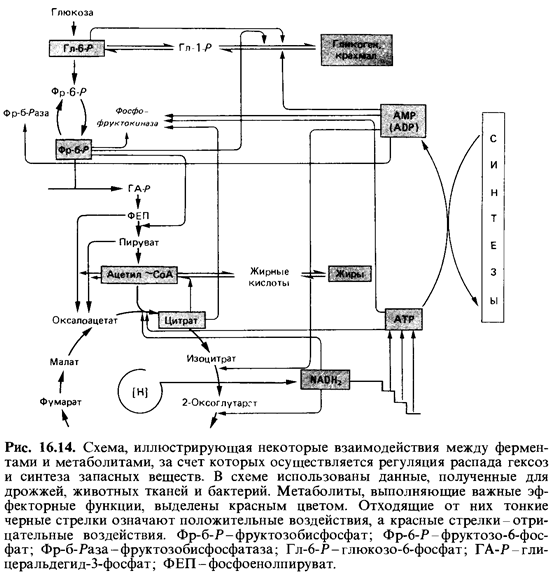
Фосфофруктокиназа и эффект Пастера. Эффект Пастера-торможе ние гликолиза дыханием - можно объяснить тем, что между системами фосфорилирования в дыхательной цепи и на уровне субстрата существует конкуренция за ADP и фосфат (разд. 8.1). Согласно новейшим данным, расщепление гексоз по фруктозобисфосфатному пути контро-
лируется в первую очередь путем аллостерической регуляции активно сти фосфофруктокиназы (рис. 16.14). Фосфофруктокиназу из пекарских дрожжей аллостерически ингибирует АТР. В присутствии АТР увеличивается сигмоидность кривой насыщения фермента субстратом. Очень важно то, что, хотя 5'-трифосфаты инозина, гуанозина и цитозина и мо гут служить вместо АТР донорами фосфатных групп, они не выпол няют ни ингибирующей, ни регулирующей функции. Это означает, что аллостерический центр фермента обладает высокой специфичностью в отношении АТР и что его сигнал однозначен. Напротив, специфич ность каталитического центра незначительна. AMP действует как поло жительный эффектор и снимает торможение, вызываемое АТР. Другие моно- и дифосфаты не действуют совсем или действуют очень слабо. У Escherichia coli роль положительного эффектора играет не AMP, a ADP. Фосфофруктокиназа ингибируется также цитратом; при этом АТР усиливает этот эффект, а фруктозо-6-фосфат ослабляет его.
Знание аллостерических свойств фосфофруктокиназы позволяет сде лать следующий вывод: если аэробно растущие дрожжевые клетки или
клетки тканевой культуры лишить кислорода и приостановить таким образом окислительное фосфорилирование, то в клетке снизится соот ношение концентраций АТР/АМР, что приведет к повышению активно сти фермента и соответственно к ускорению реакции. То, что регуляция процессов в живой клетке действительно происходит описанным путем, удалось подтвердить, измеряя внутриклеточные концентрации глюкозы, глюкозо-6-фосфата, фруктозо-6-фосфата, фруктозо-1,6-бисфосфата и триозофосфатов до и после перехода от анаэробных условий к аэ робным. Непосредственно после аэрирования культуры концентрация глюкозо-6-фосфата и фруктозо-6-фосфата возрастает, а содержание фруктозобисфосфата и триозофосфатов резко снижается. Таким обра зом, фосфофруктокиназа действует как клапан, регулируемый аденила-тами и другими метаболитами; когда он закрыт, метаболиты, находя щиеся «выше» него в цепи, накапливаются, а расположенные «ниже» продолжают участвовать в реакциях, и их количества уменьшаются. Это позволяет понять, почему при переходе к аэробным условиям по требление глюкозы падает.
Глюконеогенез. Аденилаты ATP, ADP, AMP и СоА-производные жирных кислот оказывают регулирующее воздействие на многие реак ции, участвующие в катаболизме гексоз, в промежуточном обмене и в синтезе запасных веществ. Регуляция фосфофруктокиназы служит, по-видимому, тем главным клапаном, с помощью которого регулируется поток субстрата, направляемый по фруктозобисфосфатному пути. Соответствующий фермент, контролирующий у некоторых бактерий рас щепление субстрата по 2-кето-3-дезокси-6-фосфоглюконатному пути,-это, очевидно, глюкозо-6-фосфатдегидрогеназа. Ее тоже в сильной сте пени ингибируют АТР и NADH2.
Образование глюкозы из пирувата или лактата (глюконеогенез) играет определенную роль тогда, когда эти и другие вещества служат источниками углерода в отсутствие углеводов. Синтез идет по фруктозобисфосфатному пути, за исключением трех необратимых реакций (рис. 16.14). Эти этапы катализируются регулируемыми ферментами. В животных тканях путь от пирувата к фосфоенолпирувату проходит через оксалоацетат. Первая реакция катализируется пируваткарбоксила-зой и зависит от присутствия ацетил-СоА. По-видимому, ацетил-СоА играет в данном случае роль сигнала, свидетельствующего о насыщении всех реакций, использующих это соединение, в особенности реакций ко* нечного окисления через цикл трикарбоновых кислот. Такая регуляция гарантирует получение энергии и допускает синтез глюкозы лишь при избытке ацетил-СоА. Кроме того, зависимость образования оксалоаце-тата от ацетил-СоА может быть существенной для обеспечения цикла трикарбоновых кислот необходимым количеством оксалоацетата.
При глюконеогенезе реакция с участием фруктозобисфосфатазы
Фруктозо-1,6-бисфосфат + Н20 -> Фруктозо-6-фосфат + Pj
дает возможность обойти вторую необратимую реакцию цепи гликоли за. Фруктозобисфосфатазу ингибирует AMP, который служит здесь ин дикатором степени насыщения клетки высокоэнергетическими соедине ниями. Избыток AMP означает, что поступление АТР недостаточно для насыщения реакций, связанных с затратой энергии. Кажется вероятным, что в таких условиях глюконеогенез тормозится для усиления распада глюкозы и увеличения выхода энергии.
Цикл трикарбоновых кислот. У дрожжей АТР сильно понижает срод ство цитратсинтазы к ацетил-СоА. У Е.coli и других бактерий высокая концентрация NADH2 сигнализирует о насыщении дыхательной си стемы и о том, что потребление субстрата в цикле трикарбоновых кис лот должно быть снижено. Ингибитором 2-оксоглутаратдегидрогеназы, цитратсинтазы и пируватдегидрогеназы служит NADH2 (рис. 16.14).
Синтез запасных жиров. Запасные вещества накапливаются, как пра вило, в тех случаях, когда источники углерода и энергии имеются в избытке, но рост клеток невозможен из-за недостатка соединение азота или серы. Сигнал к образованию жиров (жирных кислот) и полисахари дов исходит главным образом от промежуточных продуктов. У дрож жей реакцией, лимитирующей скорость синтеза жирных кислот, являет ся карбоксилирование ацетил-СоА при участии ацетил-СоА-карбокси-лазы:
АТР
Ацетил-СоА + СОг---------- * Малонил-СоА
Биотин-фермент
Этот фермент занимает первое место на пути биосинтеза жирных кис лот с длинной цепью. Другие процессы синтеза, в которых исходным соединением служит ацетил-СоА (синтез каротиноидов, стероидов, ци трата, малата и др.), не нуждаются в активирующем воздействии мало-нил-СоА. Ацетил-СоА-карбоксилаза активируется цитратом. Повыше ние содержания цитрата, способствуя образованию малонил-СоА, тем самым стимулирует синтез жирных кислот с длинной цепью и ней тральных жиров (триглицеридов). Роль отрицательных эффекторов играют при этом СоА-производные пальмитиновой и других жирных кислот. При накоплении СоА-производных происходит ингибирование конечным продуктом.
Синтез запасных полисахаридов. Исходным соединением для синтеза запасных полисахаридов (гликогена и крахмала) служит глюкозо-1-фос фат. Он активируется нуклеозидтрифосфатом (NuTP), после чего глюко-зильная группа переносится на полиглюкозную цепь:
Фосфорилаза
Глкжозо-1-фосфат + NuTP----------- *- NuDP -глюкоза + PPj
Гликогенсинтетаза
/iNuDP-глюкоза ---------------------- *- (Глюкоза) „ +nNuDP
В то время как синтез гликогена в печени происходит с участием UDP-глюкозы, для синтеза крахмала у зеленых растений и гликогена у различных бактерий используется ADP-глюкоза. Гликогенсинтетаза печени активируется глюкозо-6-фосфатом. Регуляторные системы, имеющиеся у бактерий и растений, сильно отличаются от системы, дей ствующей в клетках печени. Регуляция осуществляется через пирофос-форилазу. У Escherichia coli, Arthrobacter и Rhodospirillum rubrum, а также в листьях шпината AMP и ADP действуют как ингибиторы, а предше ственники (глюкозо-1-фосфат)-как стимуляторы. Пирофосфорилаза Е.coli активируется фруктозобисфосфатом, глицеральдегидфосфатом и фосфоенолпируватом; фермент R.rubrum активируется пируватом, а фермент из листьев шпината - 3-фосфоглицератом, фосфоенолпируватом и фруктозобисфосфатом. Синтез полисахаридов-прекрасный при мер того, как один и тот же результат может достигаться с помощью разных регуляторных систем.
Автотрофная фиксация двуокиси углерода. Фиксация С02 в рибуло-зо-1,5-бисфосфатном цикле-один из метаболических процессов, тре бующих наибольших затрат энергии. Отсюда понятно, что существуют регуляторные механизмы, обусловливающие высокую скорость этого цикла лишь в том случае, если обеспечен достаточный приток энергии для поддержания структуры и функций клетки (для синтеза мономеров и полимеров, обновления ферментов и др.). Фосфорибулокиназа подвер жена специфической регуляции: AMP (реже ADP) ингибирует этот фер мент, a NADH2 активирует его.
Энергетический заряд клетки. Приведенные примеры подтверждают предположения о том, что аденилаты выполняют в клетке важные регу ляторные функции и что они в известной степени представляют собой общие для катаболизма и анаболизма сигналы, обеспечивающие нуж ное соотношение между получением энергии и процессами биосинтеза. Внутриклеточное содержание ATP, ADP и AMP (или, точнее, соотноше ние между этими тремя аденилатами) определяет скорость отдельных реакций, а тем самым и сложных процессов распада и синтеза.
Было принято количественное выражение для «энергетического заряда» (ЭЗ) клетки:
2АТР + ADP АТР + 0,5ADP
ЭЗ = 1/2--------------------- =------------------ .
' ATP + ADP + AMP ATP + ADP + AMP
Коэффициент 0,5 представляет собой произвольную величину, введенную для удобства (чтобы параметр мог варьировать в пределах от 0 до 1). Таким обра зом, энергетический заряд клетки служит мерой ее обеспеченности высокоэнер гетическими соединениями в расчете на общее число «аденозиновых единиц» (аденилатов). Величина его равна единице, когда весь аденилат представлен в форме АТР, и нулю, когда в клетке имеется только AMP Для клеток в экспо ненциальной фазе роста культуры эта величина обычно близка к 0,8.
Результаты проведенных исследований позволяют предполагать, что аллостерические ферменты активируются или ингибируются тем или иным аденилатом и что именно это обеспечивает согласованную регу ляцию всего метаболизма клетки. Если, например, энергетический заряд клетки возрастает, то активность катаболических ферментов снижается, а активность ферментов, участвующих в процессах синтеза, увеличи вается. При уменьшении энергетического заряда наблюдается обратная картина.