Уже в прошлом
веке было известно, что между различными микроорга низмами могут существовать
как симбиотические, так и антагонистиче ские взаимоотношения. Толчком к
выяснению материальной основы ан тибиоза послужило наблюдение Флеминга,
обнаружившего (1928), что колония гриба Penicillium notatumподавляла
рост стафилококков. Выде ляемое этим грибом вещество, которое диффундировало в
агар, получи ло название пенициллина. С тех пор было выделено множество веществ
с антибиотической активностью. Антибиотики-это вещества биологиче
ского происхождения, способные даже в низких концентрациях по давлять рост
микроорганизмов. Различают вещества, подавляющие рост микробов
(бактериостатические, фунгистатические) и убивающие их (бактерицидные,
фунгицидные и т.д.).
Продуценты
антибиотиков. К синтезу антибиотиков способны главным образом грибы из
группы Aspergillales, актиномицеты и неко торые другие бактерии. На первом
месте по химическому многообра зию синтезируемых веществ стоят стрептомицеты. К
настоящему вре мени подробно охарактеризовано более 2000 антибиотиков, однако в
качестве химиотерапевтических средств применяется всего лишь около полусотни.
Число описанных случаев антибиотических взаимо действий гораздо больше, но
многие группы микроорганизмов, в том числе не поддающиеся культивированию или с
трудом культивируемые бактерии и низшие грибы, в этом смысле еще недостаточно
изучены.
Значение
антибиотиков для образующих их организмов. Вопрос о зна чении
антибиотиков для их продуцентов в условиях их естественного обитания-в почве -
остается неясным. К образованию антибиотиков ве дут специальные биохимические
пути, относящиеся к вторичному мета болизму. Эти пути и обеспечивающие их
ферменты не являются необхо димыми для роста и выживания клеток. Генетический
аппарат, который нужен для синтеза антибиотиков, для организма в случае их
бесполез ности был бы балластом, и организм освободился бы от него в процес-
се эволюции
путем соответствующих делеций. Поскольку в природе, очевидно, сохраняется лишь
то, что целесообразно, нужно видеть в ан тибиотиках вещества, обеспечивающие их
продуцентам селективное преимущество и в естественных условиях, т.е. в почве
(например, пре имущество в конкуренции за один и тот же субстрат). Однако такие
ан тагонистические взаимоотношения в почве трудно обнаружить, по скольку
антибиотики образуются в очень малых количествах; к тому же они обычно
подавляют и рост самих продуцентов.
Постепенно
утверждается представление, согласно которому в про цессе эволюции может
сохраняться и ненужный на первый взгляд гене тический материал-даже в том
случае, если в изученных до сих пор экспериментальных условиях он оказывается
для организма балластом. Очевидно, природа более консервативна, чем это
предполагалось на за ре эры молекулярной биологии. В настоящее время
антибиотики, а так же другие вторичные метаболиты, прямую пользу которых для синтези
рующих их клеток усмотреть трудно, причисляют, образно выражаясь, к «стружкам»
обмена веществ или же к продуктам, возникшим на «игровой площадке» метаболизма.
Этот пример ясно показывает, что изучение вторичного метаболизма бактерий,
грибов и растений- одно из перспективных направлений в исследовании путей
органической эволюции.
Методы
выявления антибиотиков. Первые антибиотики были обнару жены случайно,
по образованию зон подавления роста. В чашках с пи тательным агаром, густо
засеянным тест-организмом (индикаторными бактериями), вокруг колоний гриба или
стрептомицета рост отсутство вал: антибиотик, диффундирующий из колонии в агар,
вызывал образо вание прозрачных участков в сплошном бактериальном газоне (рис.
10.4). Видами-индикаторами (тест-объектами) в таких опытах слу жат типичные
представители различных групп микроорганизмов. Для качественного испытания
продуцента антибиотика достаточно посеять его в середину чашки с питательным
агаром, а индикаторные бакте рии-в виде радиальных штрихов (штрих-тест, рис.
10.5). После инку бации по степени торможения роста различных индикаторных
организ мов судят о спектре действия антибиотика. Антибиотики различаются по
действию на грам-положительные и грам-отрицательные бактерии, на дрожжи,
дерматофиты и другие микроорганизмы. 

Большинство
антибиотиков было открыто в процессе предваритель ного отбора (скрининга). На
рис. 10.6 представлена вся последователь ность работы-от получения суспензии
почвенной пробы до опыта на животных. 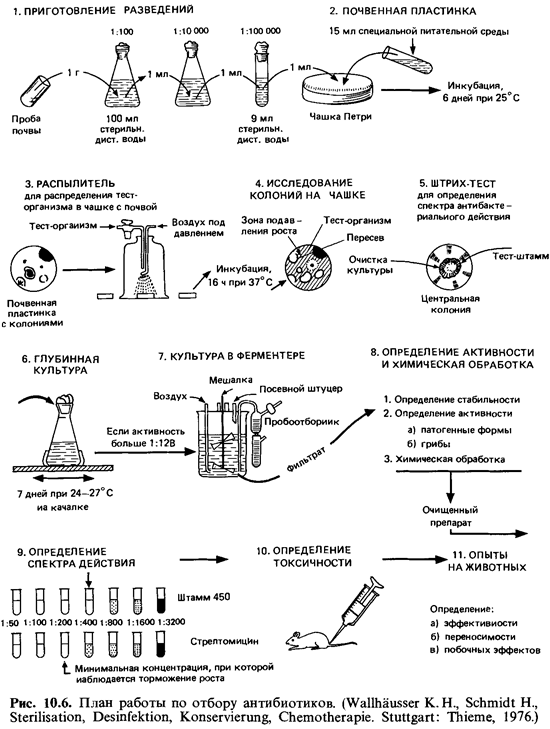
Количественное
определение. Для количественной оценки действия антибиотика пользуются
методом диффузии в агар (рис. 10.7), методом последовательных разведений и
некоторыми другими методами. Для проведения теста с диффузией чашки заполняют
до определенной вы соты агаризованной средой, содержащей суспензию
тест-организма. За тем в чашки вносят испытуемые растворы антибиотика. Их
помещают в лунки, либо в стеклянный или металлический цилиндр, или же на
кладывают на агар пропитанные антибиотиком диски из фильтроваль ной бумаги. При
положительной реакции во всех случаях после инкуба ции становится заметной зона
подавления роста тест-организма. Диаметр этой зоны при соблюдении постоянных
условий опыта (состав питательной среды, толщина слоя агара, плотность посева,
время инку бации, температура и т.д.) пропорционален логарифму концентрации
антибиотика (рис. 10.7). 
При
использовании метода последовательных разведений готовят се
рию разведений антибиотика в отношении 1:2 в питательном растворе, засеянном
тест-организмом, и после инкубации определяют ту мини мальную концентрацию
антибиотика, при которой не наблюдается ро ста (минимальную
бактериостатическую концентрацию).
Для
установления синергического и антагонистического действия разных веществ, а
также для исследования действия антибиотиков на другие организмы (на
простейших, червей, водоросли, культуры клеток, вирусы) были разработаны
специальные методы.
Важнейшие
антибиотики, применяемые в медицине. Первое место среди них все еще
принадлежит пенициллину, который синтезируют Penicillium notatum, P. chrysogenum и
некоторые другие грибы; удалось также получить полусинтетические пенициллины
(путем расщепления природных пенициллинов до 6-аминопенициллановой кислоты, к
кото рой затем химическим путем присоединяют различные боковые группы). О
механизме действия пенициллина на бактерии уже говори лось ранее.
Для человека пенициллин почти не токсичен и лишь в редких случаях вызывает
побочные аллергические реакции. Многие бактерии образуют пенщиллиназу, которая
расщепляет (3-лакта-мовое кольцо и инактивирует пенициллин. Воздействуя на
6-аминопени-циллановую кислоту хлорангидридами кислот, можно получать сотни
пенициллинов (рис. 10.8). Многие полусинтетические пенициллины не расщепляются
пенициллиназой и ввиду их устойчивости к действию кислот могут вводиться
перорально. 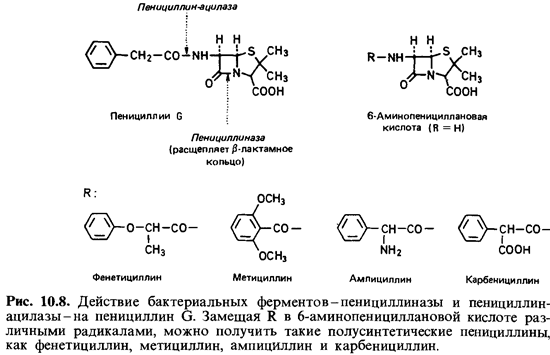
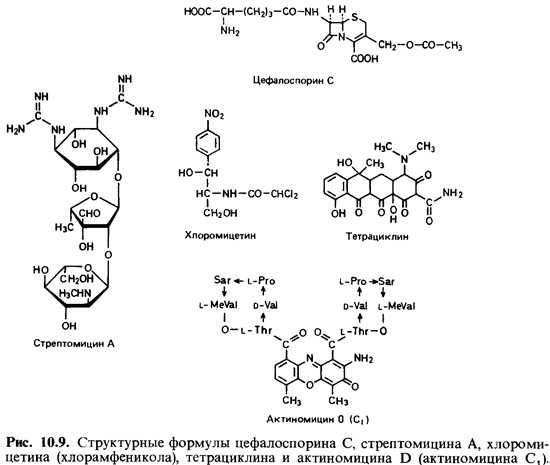
Цефалоспорины- продукты
одного из видов гриба Cephalosporium. Цефалоспорин С имеет
(3-лактамовое кольцо и по своей структуре бли зок к пенициллину (рис. 10.9).
Отщепляя боковую цепь и затем присоеди няя к образовавшейся
7-аминоцефалоспорановой кислоте другие бо ковые группы, можно получать
полусинтетические цефалоспорины (цефалотин, цефалоридин), которые по своему
действию сходны с производными пенициллина.
Стрептомицин был
впервые выделен из культуры Streptomyces griseus, однако
его синтезируют и некоторые другие виды Streptomyces. Молеку
ла стрептомицина состоит из трех частей: М-метил-Ь-2-глюкозамина, метилпентозы
и дигуанидинзамещенного инозитола (рис. 10.9). Успех применения стрептомицина
объясняется его действием на ряд кислото устойчивых и грам-отрицательных
бактерий, нечувствительных к пени циллину. Однако стрептомицин вызывает у
больных резко выраженные аллергические реакции. Этот антибиотик применяется
также в ветерина рии и для борьбы с болезнями растений.
Хлоромицетин
(хлорамфеникол) был впервые обнаружен в культурах Streptomyces venezuelae, но
его можно получить и синтетическим путем (рис. 10.9). Он отличается
исключительной стабильностью и действует на многие грам-отрицательные бактерии,
включая спирохеты, риккетсии и актиномицеты, а также на крупные вирусы.
Тетрациклины тоже
представляют собой метаболиты различных стрептомицетов (в том числе Streptomycesaureofaciens). Химически
они очень близки между собой и имеют в основе структуры нафтацен (рис. 10.9).
Наиболее известны хлортетрациклин (ауреомицин), оксите-трациклин (террамицин) и
тетрациклин. Тетрациклины отличаются ши роким спектром действия и хорошей
переносимостью.
К макролидам относятся
антибиотики разного происхождения с от носительно большой молекулярной массой,
для которых характерно макроциклическое лактоновое кольцо (эритромицин,
карбомицин А, пи-кромицин и др.).
Актиномицин был
выделен в 1940 г.
(первым среди антибиотиков, образуемых стрептомицетами). Это смесь нескольких
веществ; объеди няет их только феноксазоновый хромофор. Роль заместителей
играют различные полипептидные цепочки (рис. 10.9).
Наконец,
следует упомянуть еще группу полипептидных антибиоти ков (грамицидин S,
полимиксины, бацитрацин, ристоцетин и др.). В мо лекуле полимиксина В к кольцу
из семи аминокислот присоединена с помощью пептидной связи боковая цепь (рис.
10.10). Полипептидные антибиотики обладают высоким сродством к плазматической
мембра не, поэтому они одинаково токсичны как для бактерий, так и для эука-риот
и не применяются в клинике. Благодаря своей способности изби рательно
транспортировать ионы через мембрану полипептидные антибиотики могут
применяться в исследовательских целях в качествеионофоров . Валиномицин, например,
облегчает транспорт ионов калия через мембрану. В состав молекулы этого
антибиотика входит кольцо из 12 звеньев (среди них валин, 2-гидроксиизовалерат
и лактат). Структура этого кольца такова, что ион калия как раз поме щается во
внутреннем пространстве молекулы. Комплекс валиномицина с К+
благодаря присутствию валина и валерата липофилен и легко транспортируется
через липидный слой мембраны. Поэтому добавление валиномицина к клеточной
суспензии ведет к потере клетками ионов калия. 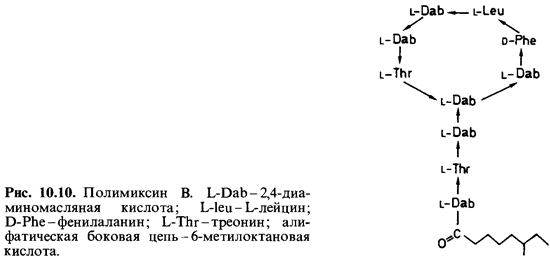
В
фармацевтической промышленности для производства антибиотиков используются
сейчас не исходные штаммы микроорганизмов, а более продуктивные мутанты. Штамм
гриба, открытый Флемингом, синтезировал лишь около 3 мкг пенициллина на 1 мл
среды. Современные штаммы-продуценты дают минимум в 2000 раз больше. Такое
повышение выхода антибиотиков-результат мутаций и отбора более активных
штаммов, улучшения состава питательных сред и оптимизации условий производства.
Пути биосинтеза многих антибиотиков уже выяснены, и задача состоит сейчас в
том, чтобы еще больше повысить продуктивность микроорганизмов путем получения
и более целенаправленного отбора мутантов. |