Если во время
роста клеток промежуточные продукты цикла трикарбоновых кислот используются в
биосинтетических процессах, недостаток этих продуктов компенсируется
восполняющими (анаплеротическими) реакциями. Одна из функций таких реакций -
регенерация оксалоацета та, из которого в результате взаимодействия с
ацетилкоферментом А образуется цитрат.
Когда
субстратом для роста клетки служит глюкоза, этот сахар используется для синтеза
всех клеточных компонентов, содержащих глюкозу, рибозу, дезоксирибозу и другие
производные сахаров. В этом случае анаплеротические реакции обеспечивают прежде
всего бесперебойную работу цикла трикарбоновых кислот. При росте
микроорганизмов на среде с лактатом, пируватом, ацетатом, глиоксилатом и
другими углеродными соединениями дополнительные метаболические пути необходимы
не только для поддержания цикла трикарбоновых кислот, но и для образования
промежуточных продуктов, используемых при биосинтезе сахаров (глюконеогенезе).
Глюкоза как субстрат. Важнейшими и
наиболее распространенными анаплеротическими реакциями, восполняющими расход
промежуточных продуктов цикла трикарбоновых кислот у животных, растений и микроорганизмов,
являются реакции карбоксилирования С3-кислот (пирувата,
фосфоенолпирувата), ведущие к образованию
оксалоацетата (рис. 7.13). В животных тканях (в печени и почках), а также
в клетках не которых псевдомонад происходит карбоксилирование пирувата при участии
пируваткарбоксилазы: 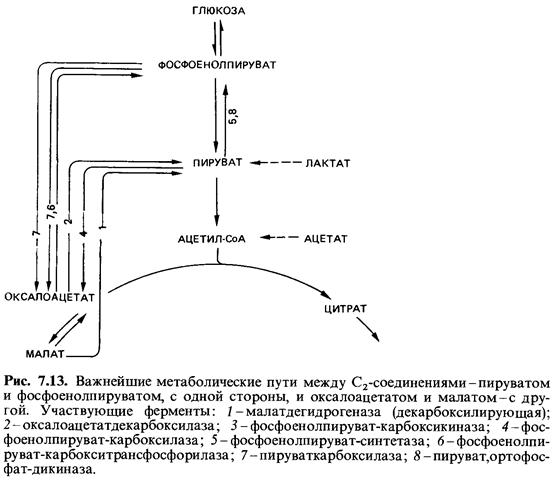
Пируват + С02 +
АТР -> Оксалоацетат + ADP + Pj
Самой
распространенной реакцией следует, по-видимому, считать карбоксилирование
фосфоенолпирувата (ФЕП) с помощью ФЕП-карбоксилазы:
ФЕП + С02 +
Н20 -> Оксалоацетат + Pi
Эта реакция
практически необратима.
Лактат,
пируват и другие С3-соединения как субстраты. При росте на
средах с пируватом или родственными соединениями клеткам приходится не только
восполнять расход промежуточных продуктов цикла трикарбоновых кислот, но, кроме
того, синтезировать глюкозу и ее производные, т. е. осуществлять глюкоиеогенез. Синтез
сахаров из лактата происходит через те же промежуточные соединения, что и
гликолиз (фруктозобисфосфатный путь). Однако этапы, катализируемые гексокиназой,
фосфофруктокиназой и пируваткиназой, необратимы, и для их обхода используются
ферментативные реакции, которые являются экзергоническими, когда процесс
протекает в направлении синтеза глюкозы (рис. 7.3). В животных тканях (печень,
почки) существует следующий путь в обход практически необратимой
пируваткиназной реакции: сначала пируват карбоксилируется в оксалоацетат (под
действием пируваткарбоксилазы), а последний при участии ФЕП-карбоксикиназы превращается
в фосфоенолпируват (ФЕП):
Оксалоацетат
+. GTP -* ФЕП + С02 + GDP
Этот синтез,
ведущий от пирувата через оксалоацетат к фосфоенол-пирувату, требует двух
высокоэнергетических фосфатов: одного для карбоксилирования пирувата, а другого
- для образования фосфоенол пирувата из оксалоацетата.
Недавно
выяснилось, что обратная реакция, катализируемая ФЕП-карбоксилазой, - это
единственный путь синтеза оксалоацетата из С3-соединений у многих
строго анаэробных бактерий (и червей). В среде с высоким содержанием СО2 эта
реакция протекает преимущественно в сторону
образования оксалоацетата.
У Escherichia coli и
других бактерий пируват непосредственно фосфорилируется под действием
ФЕП-синтетазы (рис. 7.13):
Пируват
+ АТР + Н20 -►
ФЕП + AMP + Р;
Для этого
тоже требуются две высокоэнергетические фосфатные связи. Синтез оксалоацетата
происходит в этом случае под действием ФЕП-карбоксилазы. Пируваткарбоксилаза у Е. coli отсутствует.
Пропионовые
(пропионовокислые) бактерии, Acetobacter aceti, Entamoeba histolytica и Fusobacteriumsymbiosus
имеют еще один фермент, образующий ФЕП из пирувата, а именно
пируват-ортофосфатдикиназу, которая катализирует обратимую реакцию: Пируват +
АТР + Р| ^i Фосфоенолпируват + АМР+ РР,
Следует
отметить, что высокоэнергетическая связь дифосфата при этом сохраняется. У С4-растений,
накапливающих дикарбоновые кислоты (кукуруза, сахарный тростник), пируват-ортофосфатдикиназа
тоже ответственна за синтез фосфоенолпирувата, который затем с помощью
ФЕП-карбоксилазы превращается в оксалоацетат.
Ацетат как субстрат. Рост
микроорганизмов на среде с ацетатом или соединениями, катаболизм которых ведет
к образованию ацетата (жирные кислоты, углеводороды), оказывается возможным
благодаря глиоксилатному циклу, или циклу Кребса-Корнберга (рис. 7.14). Эта анаплеротическая
последовательность реакций протекает при участии двух ферментов: изоцитратлиаза расщепляет
изоцитрат на сукцинат и глиоксилат:
Таким
образом, под действием изоцитратлиазы и малатсинтазы происходит превращение
одного моля изоцитрата и одного моля ацетилкофермента А в два моля С4-дикарбоновых
кислот. Эти кислоты под действием малатдегидрогеназы (декарбоксилирующей) превращаются
в пируват или под действием ФЕП-карбоксилазы - в фосфоенолпируват, т. е. могут
использоваться для глюконеогенеза. Кроме того, из этих соединений образуется
оксалоацетат для цитратсинтазной реакции, что служит источником строительных блоков
для процессов биосинтеза. Для поддержания цикла трикарбоновых кислот во время
превращений глюкозы, а также пирувата или других С3-соединений
глиоксилатный цикл, видимо, существенного значения не имеет. 
Глиоксилат как субстрат. Когда
источником углерода служит глиоксилат (или его предшественники - гликолат,
мочевая кислота), индуцируются ферменты D-глицератного пути. Две молекулы
глиоксилата под действием синтазы тартроновой кислоты (этот фермент называют
так же глиоксилаткарболигазой) превращаются в полуальдегид тартроновой кислоты
(2-гидрокси-З-оксопропанат) с выделением СО2. Этот альдегид
восстанавливается с помощью специфической редуктазы до D-глицерата и
фосфорилируется с образованием 3-фосфоглицерата:
Образующийся
из 3-фосфоглицерата обычным путем ацетилкофермент А включается в цикл
трикарбоновых кислот и окисляется (рис. 17.15). Поставку промежуточных
продуктов обеспечивает малатсинтаза; она катализирует реакцию еще одной
молекулы глиоксилата с ацетилкоферментом А, в результате которой образуется
малат.
В то время
как ферменты главных метаболических путей всегда присутствуют в клетках,
растущих, например, на таких субстратах, как глюкоза, ферменты вспомогательных
циклов могут быть индуцибельными. При росте на средах с глюкозой содержание
этих ферментов в клетках очень невелико, и часто их с трудом удается выявить.
Этот минимальный уровень ферментативной активности называют основным уровнем. Лишь
после переноса клеток в питательную среду, содержащую в качестве единственного
источника энергии и углерода ацетат или глиоксилат, индуцируется синтез
соответствующих ферментов. При полной индукции содержание таких ферментов может
в 100 и более раз превышать основной уровень. Определяя их
активность до и после смены субстрата, можно установить,
действительно ли их образование было индуцировано субстратом. Если фермент
образовался, то мы вправе заключить, что он участвует в метаболизме нового
субстрата. Однако для полной уверенности следует провести опыты с мечеными
соединениями, т.е. внести в среду вещества с радиоактивной меткой, а затем
убедиться в том, что меченые атомы вошли в состав промежуточных и конечных
продуктов метаболизма.
Не следует
думать, что все ферменты, участвующие в углеводном обмене, входят в постоянный
набор клеточных ферментов, т. е. являются конститутивными. Если, например,
бактериальные клетки растут на среде с ацетатом, то в них часто образуются
только те из ферментов обмена глюкозы, которые участвуют также и в
глюконеогенезе; ферменты же, катализирующие только реакции катаболизма глюкозы,
содержатся в таких клетках лишь в малых количествах или вовсе не выявляются.
Если среда
содержит сразу два субстрата, то клетки нередко используют только один из них.
Например, при росте Escherichia coli или псевдомонад на среде
с глюкозой и ацетатом сначала метаболизируется глюкоза. Ферменты, необходимые
для использования ацетата, не образуются - их синтез не индуцируется до тех
пор, пока в среде присутствует глюкоза. В таком случае говорят о катаболитной
репрессии синтеза ферментов, необходимых для использования ацетата. |