В то время
как большинство анаэробных организмов способно синтезировать АТР только путем
фосфорилирования на уровне субстрата, аэробы могут осуществлять несравненно
более эффективную регенерацию АТР. Они обладают особым аппаратом: дыхательной
(электрон-транс портной) цепью и ферментом ATР-синтазой;
обе системы у прокариот находятся в плазматической мембране, а у эукариот – во
внутренней мембране митохондрий. Ведущие свое происхождение от субстратов
восстановительные эквиваленты (Н или электроны) в этих мембранах по ступают в
дыхательную цепь, и электроны переносятся на О2 (или другие
терминальные акцепторы электронов). В дыхательной цепи происходят реакции,
представляющие собой биохимический аналог сгорания водорода. От химического
горения молекулярного водорода они отличаются тем, что значительная часть
свободной энергии переводится при этом в биологически доступную форму, т. е. в
АТР, и лишь небольшая доля рассеивается в виде тепла.
Механизм
окислительного фосфорилирования. Отданные субстратами восстановительные
эквиваленты (протоны и электроны) переносятся на плазматическую мембрану или на
внутреннюю мембрану митохондрий. Через мембрану они транспортируются таким
образом, что между внутренней и внешней сторонами мембраны создается
электрохимический градиент с положительным потенциалом снаружи и отрицательным
внутри (рис. 7.8). Этот перепад заряда возникает благодаря определенному
расположению компонентов дыхательной цепи в мембране. 
Некоторые из
этих компонентов переносят электроны, другие переносят водород.
Взаиморасположение переносчиков в мембране таково, что при транспорте
электронов от субстрата к кислороду протоны (Н +) связываются
на внутренней стороне мембраны, а освобождаются на внешней. Можно представить
себе, что электроны в мембране проходят зигзагообразный путь и при этом
переносят протоны изнутри наружу. Эта система, транспортирующая электроны и
протоны, получила название дыхательной или электронтранспортной цепи.
Иногда ее образно называют «протонным насосом», так как главная функция этой
системы - перекачивание протонов.
Неравновесное
распределение зарядов, т.е. электрохимический градиент, служит движущей силой
для процесса регенерации АТР (и других процессов, требующих затраты энергии).
Мембрана содержит специальный фермент АТР-синтазу, синтезирующий АТР из ADP и
Pj. Этот фермент выступает из мембраны с ее внутренней стороны. В процессе
синтеза АТР протоны переходят обратно с наружной стороны мембраны на
внутреннюю. Синтез АТР за счет энергии транспорта электронов через мембрану
называют окислительным фосфорилированием или фосфорилированием
в дыхательной цепи.
Для того
чтобы понять механизм дыхания, необходимо знать 1) компоненты дыхательной цепи,
2) их окислительно-восстановительные потенциалы и 3) их взаиморасположение в
мембране.
Мембраны как место
осуществления дыхания. Компонентами дыхательной цепи являются ферментные белки
с относительно прочно связанными низкомолекулярными простетическими группами.
Давнюю мысль о том, что «дыхание» - это катализ, осуществляемый железом на
поверхностях» (О. Варбург), можно считать справедливой. Действительно, ферменты
дыхательной цепи структурно связаны. У эукариот они локализуются во внутренней
мембране митохондрий, а у прокариот – в плазматической мембране. Механизм
действия и локализация компонентов дыхательной цепи в тех и других мембранах во
многом сходны. Дыхательная цепь Alcaligenes eutrophus и Paracoccus denitrificans почти
идентична дыхательной цепи митохондрий.
Компоненты
дыхательной цепи погружены в двойной липидный слой. Речь идет о
большом числе ферментов, коферментов и простетических групп, различных
дегидрогеназ и транспортных систем, участвующих в переносе электронов и
водорода. Белковые компоненты могут быть выделены из мембраны. Важнейшие из
компонентов, участвующих в окислении водорода, - это флавопротеины,
железосерные белки, хиноны и цитохромы. 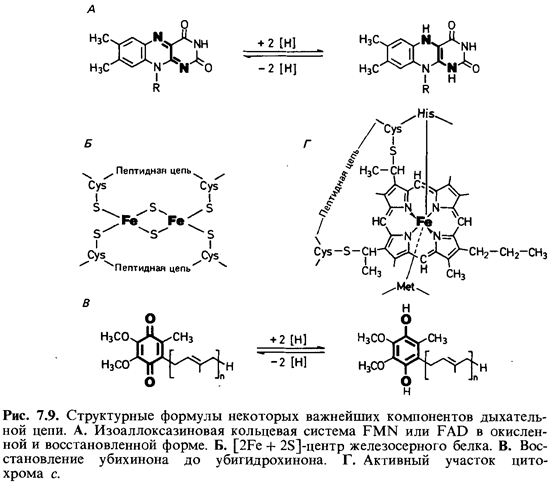
Флавопротеины представляют
собой ферменты, содержащие в качестве простетических групп флавинмононуклеотид
(FMN) или флавинадениндинуклеотид (FAD). Эти ферменты переносят водород.
Активной группой в них является изоаллоксазиновая система (рис. 7.9, А), которая
действует как обратимая окислительно-восстановительная система. Реагирующими
центрами служат два атома азота, каждый из которых может связаться с одним [Н].
Связывание может происходить в два этапа через состояние семихинона. Благодаря
способности переносить то по два атома водорода, то по одному флавопротеины
могут быть посредниками между двумя типами процессов переноса водорода.
Железосерные
белки - это окислительно-восстановительные системы, переносящие электроны.
Они содержат атомы железа, связанные, с одной стороны, с серой аминокислоты
цистеина, а с другой - с неорганической сульфидной серой (рис. 7.9, Б).
Последняя очень легко отщепляется в виде сероводорода при подкислении. Остатки
цистеина входят в состав полипептидных цепей; Fe-S - центры можно рассматривать
как простетические группы полипептида. Участвующие в дыхательной цепи [2Fe + 2S]-центры способны переносить
только один электрон. Железосерные белки типа [2Fe + 2S], имеющие по два атома
лабильной серы и железа, содержатся в нескольких ферментных комплексах
дыхательной цепи. Из общего количества находящегося в плазматической мембране
железа 80% содержится в Fe-S-белках и только 20% - в цитохромах.
Помимо
транспорта электронов в мембранах Fe-S-белки участвуют в фиксации молекулярного
азота, в восстановлении сульфита и нитрита, в фотосинтезе, в освобождении и
активации молекулярного водорода и в окислении алканов. Fe-S-белки имеют
относительно низкую молекулярную массу и сильно отрицательный
окислительно-восстановительный потенциал; величины Е, находятся в
пределах от - 0,2 до - 0,6 В. Помимо железосерных белков с [2Fe 4-+ 2S]-центрами (в хлоропластах,
у аэробных бактерий) существуют и другие - с [4Fe 4- 4S] - центром (у Clostridium, Chromatium). а
также такие, которые содержат по два [4Fe + 4S] - центра (у Clostridium, Azotobacter). Железосерные белки получили название
по своему происхождению или по функции: ферредоксин, путидаредоксин,
рубредоксин, адренодоксин
Еще одну группу окислительно-восстановительных
систем в дыхательной цепи составляют хиноны. Во внутренней мембране митохондрий
и у грам-отрицательных бактерий имеется убихинон (кофермент Q; рис. 7.9, В), у
грам-положительных бактерий -нафтохиноны, а в хлоропластах - пластохиноны. Хиноны,
в частности убихинон, липофильны и поэтому локализуются в липидной фазе
мембраны. Они способны переносить водород или электроны. Перенос может
осуществляться в два этапа, при этом в качестве промежуточной формы выступает
семихинон. По сравнению с другими компонентами дыхательной цепи хиноны
содержатся в 10-15-кратном избытке. Они служат «сборщиками» водорода,
поставляемого различными коферментами и простетическими группами в дыхательной
цепи, и передают его цитохромам.
Цитохромы -
окислительно-восстановительные системы, переносящие только электроны; водород
они не транспортируют. К цитохромам электроны поступают от пула хинонов. При
переносе электронов эквивалентное им число протонов переходит в раствор. В
качестве простетической группы цитохромы содержат гем (рис. 7.9). Центральный
атом железа геминового кольца участвует в переносе электронов, изменяя свою
валентность. Цитохромы окрашены; они отличаются друг от друга спектрами
поглощения и окислительно-восстановительными потенциалами. Различают цитохромы а,
аb,b, с, о и ряд
других. В цитохроме с группы гема ковалентно связаны с
цистеиновыми остатками апопротеина; благодаря такой прочной связи он растворим
в воде и его можно экстрагировать из мембраны солевыми растворами.
Цитохром с найден почти у всех организмов, обладающих
дыхательной цепью. Что касается распространенности других цитохромов, то тут
существуют заметные различия.
Цитохромы
участвуют также в переносе электронов на кислород. Цитохромоксидаза (цитохромааb) - терминальная
оксидаза, реагирующая с кислородом и передающая ему четыре электрона:
02
+ 4Fe2+ -► 202"
+ 4Fe3 +
Часто
встречающийся у бактерий цитохром о также может реагировать с
молекулярным кислородом. Эта терминальная оксидаза может быть ингибирована
цианидом или окисью углерода.
Наличие
цитохромов долгое время рассматривалось как признак принадлежности к аэробным
или фототрофным организмам. Открытие цитохрома с3 у Desulfovibrio вначале
казалось неожиданным, но затем стало понятно, что воcстановление сульфата этими сульфатредуцирующими
бактериями позволяет им осуществлять окислительное фосфорилирование в
анаэробных условиях и, таким образом, формально соответствует дыханию. Недавно
выявилось, что аэротоле рантные молочнокислые бактерии Streptococcus lactis и Leuconostoc mesenteroidesи
анаэроб Bifidobacterium тоже синтезируют цитохромы, если
растут на средах, содержащих гемин или кровь. Цитохромы были обнаружены также у
строгих анаэробов Selenomonas ruminantium, Veillonellaalcalescens, Vibrio succinogenes, Clostridium formicoaceticum и С. thermoaceticum. Вполне
возможно, что и у некоторых других строго анаэробных бактерий будут найдены
цитохромы и способность в какой-то мере осуществлять фосфорилирование,
сопряженное с транс портом электронов.
| 






