Белки состоят
из аминокислот, соединенных в определенной последовательности пептидными
связями в полипептидные цепи. Эти цепи имеют совершенно определенную
пространственную конфигурацию (конформацию), которая стабилизируется
дополнительными связями - ковалентными и нековалентными (рис. 2.18). В
зависимости от роли, которую играют в поддержании структуры те или иные связи,
различают несколько структурных уровней. 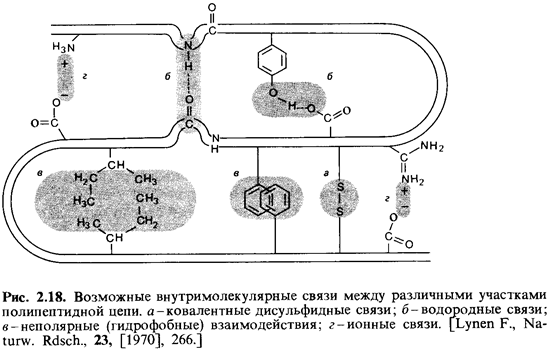
Первичная
структура белка определяется числом и последовательностью ковалентно
связанных аминокислот. Полипептидная цепь благодаря водородным связям,
образующимся между кислородными атомами карбонильных групп и азотными атомами
амидных групп, приобретает вторичную структуру; она может
образовать спиральную конфигурацию (а-спираль) или конфигурацию так называемого
складчатого слоя. Третичной структурой называют определенное
пространственное расположение пептидной цепи, обусловленное взаимодействием
между различными ее боковыми группами. В поддержании третичной структуры
участвуют другие водородные связи, ионные связи и неполярные (гидрофобные)
взаимодействия. Поперечные связи, соединяющие различные участки полипептид ной
цепи, могут быть и ковалентными; таковы, например, дисульфидные связи,
образующиеся при окислении SH-групп. И наконец, благодаря взаимодействиям
нескольких полипептидных цепей могут возникать надмолекулярные агрегаты. Такое
строение (при котором белок состоит из определенного числа полипептидных цепей,
или субъединиц) называют четвертичной структурой. При
физиологических условиях белок находится в водной фазе. Поэтому между белками и
диполями воды тоже имеет место взаимодействие. Полярные группы гидратированы.
Факторы, вызывающие изменение заряда белков (концентрации ионов Н +,
Са2 +, Mg2 +, К + и
др.), неизбежно влияют также на степень гидратации, а тем самым и на степень
набухания белков. | 






