Азот
органических соединений - это прежде всего белковый азот. Подобно другим
высокомолекулярным соединениям, белки сначала рас щепляются внеклеточными
протеазами на фрагменты, способные проникнуть в клетку, - полипептиды,
олигопептиды и отчасти аминокис лоты. Пептиды поступают в клетки и
гидролизуются внутриклеточны ми протеазами до аминокислот. Последние либо
используются клеткой как таковые для синтеза белка, либо подвергаются
превращениям, в ре зультате которых они в конечном счете дезаминируются и после
этого вовлекаются в промежуточный обмен (рис. 14.14). 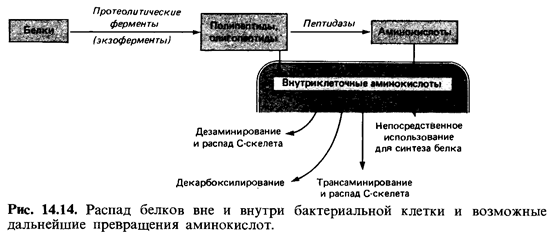
Продукты
неполного переваривания белков первоначально называли пепто нами. В настоящее
время это название, недостаточно определенное по смыслу, сохранилось только для
обозначения того продукта, который применяют для приготовления питательных
бактериальных сред. Его получают, обрабатывая белки ферментом пепсином (при
этом разрывается только часть пептидных свя зей). Пептон состоит примерно на
30% (по весу) из свободных аминокислот; остальное составляют ди- и
трипептиды, а также водорастворимые, уже не
осаждаемые нагреванием или кислотой полипептиды.
Распад белков
в почве сопровождается образованием аммиака. По этому говорят о минерализации
азота, или аммонификации. В разложе нии белков участвуют
многочисленные грибы и бактерии, в том числеBacillus cereus var. mycoides, псевдомонады, Proteus vulgaris и
другие.
Первой
реакцией, затрагивающей аминокислоты, может быть декар боксилирование илидезаминирование. Декарбоксилазы
образуются главным образом в кислой среде. В результате декарбоксилирования
аминокислот образуются С02 и первичные амины (называемые также
«биогенными аминами»). Из них наиболее известны кадаверин, путрес-цин и агматин
(ранее их называли птомаинами или трупными ядами); они образуются
соответственно из лизина, орнитина и аргинина. Пер вичные амины обнаруживаются
при обычных гнилостных процессах в кишечнике и при других анаэробных процессах
распада белковых веществ.
Под
дезаминированием понимают отщепление аммиака от амино кислоты. В зависимости от
судьбы углеродного скелета аминокислоты различают окислительное
дезаминирование, гидролитическое дезамини рование и дезаминирование, приводящее
к образованию ненасыщенных соединений.
Окислительное
дезаминирование- наиболее распространенный тип распада аминокислот.
Глутаминовая кислота дезаминируется глута-матдегидрогеназой до
2-оксоглутаровой кислоты. Реакция обратима и поэтому играет важнейшую роль в
обмене аминокислот. Равновесие в сильной степени сдвинуто в сторону образования
глутаминовой кислоты:
Примером
дезаминирования, приводящего к образованию ненасы щенного соединения, служит
дезаминирование аспарагиновой кислоты в фумаровую:
NH3
НООС-CHNH2-СН2-СООН
. »'
' НООС-СН=СН-СООН
Эта реакция,
катализируемая аспартазой, тоже обратима.
Гидролитическим
дезаминированием является, например, гидролиз мочевины. Большое число
бактерий способно использовать мочевину в качестве источника азота. Мочевина
расщепляется уреазой:
H2N-CO-NH2
+ Н20 - 2NH3
+ С02
У большинства
бактерий синтез уреазы подавляется ионами аммо ния. Благодаря этому количество
образующегося и выделяющегося в культуральную жидкость аммиака не превышает
того, что требуется для синтеза белков. Лишь у немногих бактерий, известных
своей спо собностью разлагать мочевину (Bacilluspasteurii, Sporosarcina ureae, Proteus vulgaris и
др.), уреаза представляет собой конститутивный фер мент; для ее образования не
требуется индукции мочевиной, и аммиак не подавляет ее синтеза. Эти бактерии
могут, таким образом, расще плять всю имеющуюся мочевину (например, в конюшнях)
до аммиака. В результате рН среды сдвигается до тех значений (рН 9-10), к
которым эти бактерии приспособлены.
При трансаминировании аминогруппа
аминокислоты переносится на 2-оксокислоту:
Путем
трансаминирования образуются аминокислоты, которые не мо гут быть синтезированы
путем прямого аминирования аммиаком; с трансаминированием связано также
расщепление некоторых амино кислот.
В
реакциях декарбоксилирования и
трансаминирования (см. рис. 14.15) участвует
пиридоксальфосфат. 
Этот
кофермент, участвующий в обмене аминокислот, родствен пи-ридоксолу, известному
также как адермин или витамин В6. Роль реак-ционноспособной группы в
молекуле пиридоксальфосфата играет альде гидная группа. При взаимодействии этой
группы с аминогруппой аминокислоты образуется шиффово основание. В процессе
трансамини-рования аминогруппа остается связанной с пиридоксальфосфатом, а
углеродный скелет аминокислоты отщепляется в виде 2-оксокислоты.
Пиродоксальфосфат регенерируется затем в результате реакции с со ответствующей
оксокислотой. При декарбоксилировании от шиффова основания отщепляется С02.
Дальнейшая
судьба углеродного скелета у разных аминокислот раз лична.
Лишь немногие продукты дезаминирования (пировиноградная, 2-оксоглутаровая,
щавелевоуксусная кислоты) являются одновременно промежуточными продуктами
центральных путей катаболизма. Другие углеродные скелеты через специальные
катаболические пути вовлекают ся в промежуточный обмен. Мы не ставили здесь
задачу охарактеризо вать все известные пути распада. В качестве типичного
примера на рис. 14.15 представлен путь расщепления лейцина. Особого внимания
заслуживает здесь 3-гидрокси-З-метилглутарил-СоА - важный промежу точный
продукт в синтезе стероидов и каротиноидов.
| 






