Горячие источники в Беппу (Япония) — излюбленные места обитания термофильной цианобактерииThermosynechococcus elongatus. Фото с сайта nonstoptotokyo.co.uk Характерной особенностью геномов высших организмов
являются многочисленные интроны — некодирующие вставки в генах,
которые вырезаются из РНК перед трансляцией (синтезом белка).
Предполагают, что интроны эукариот произошли от особой разновидности мобильных
генетических элементов — так называемых «интронов группы II», встречающихся
у бактерий. Эта гипотеза получила новые подтверждения в ходе изучения
термофильного микроба Thermosynechococcus elongatus — бактерии, в геноме
которой содержится наибольшее количество мобильных элементов этого типа.
Высокая температура могла быть одной из главных причин быстрого размножения
интронов группы II в геномах T. elongatus и древних
эукариот.
Большинство генов эукариот содержит интроны — некодирующие вставки, которые необходимо
вырезать из матричной РНК, прежде чем использовать ее в качестве матрицы
для синтеза белка. Вырезание интронов и сшивание кодирующих участков мРНК
(экзонов) называют сплайсингом. Большинство интронов в ядерных генах
эукариот — это так называемые сплайсосомные интроны, которые удаляются из
мРНК при помощи специальных молекулярных «машинок» — сплайсосом (подробнее о сплайсинге см. в заметках: Сравнение геномов
человека и мыши помогло обнаружить новый способ регуляции работы генов,
«Элементы», 21.04.2007; Почти все человеческие гены кодируют более одного белка,
«Элементы», 08.11.2008).
Многие факты, обнаруженные в последние годы, указывают
на то, что сплайсосомные интроны эукариот, скорее всего, произошли от так
называемых «интронов группы II» (group II
introns) — мобильных генетических элементов, встречающихся в геномах
бактерий, митохондрий и пластид (органелл эукариотической клетки, произошедших
от симбиотических бактерий). У архей они встречаются редко. По-видимому,
некоторые археи приобрели интроны группы II от бактерий в результате
горизонтального генетического обмена.
Интроны группы II являются разновидностью ретротранспозонов.
Типичный интрон группы II содержит два функциональных блока: участок,
способный сворачиваться в трехмерную структуру с каталитической активностью
(рибозим), и ген белка IEP (intron-encoded protein).
Как и положено ретротранспозонам, интроны
группы II умеют размножаться, встраивая свои копии в строго определенные
места хозяйского генома. Происходит это так. Сначала интрон группы II
должен быть транскрибирован, то есть хозяйская клетка должна синтезировать на
матрице гена, содержащего интрон группы II, молекулу мРНК, в состав
которой войдет и копия интрона. Затем та часть мРНК, которая кодирует
белок IEP, вступает во взаимодействие с рибосомой и подвергается
трансляции, то есть используется в качестве инструкции для синтеза
белка IEP. Этот белок затем вступает во взаимодействие с той частью мРНК,
которая является рибозимом, и помогает ей принять правильную трехмерную
конфигурацию. После этого активированный рибозим осуществляет свой собственный
сплайсинг: он вырезает сам себя из молекулы мРНК. Детали этого процесса очень
похожи на «настоящий» сплайсинг, осуществляемый сплайсосомами. Это важный
аргумент в пользу происхождения сплайсосомных интронов и сплайсосом от
интронов группы II.
После этого комплекс из белка IEP и интрона
разрезает хозяйскую ДНК в подходящем месте. У каждого интрона
группы II есть свои излюбленные места для встраивания. Белок IEP
осуществляет обратную транскрипцию, то есть синтезирует ДНК на матрице РНК
интрона. Ферменты хозяйской клетки, отвечающие за копирование и починку ДНК,
помогают завершить начатое, зашивая разрывы и синтезируя вторую
(комплементарную) нить ДНК на матрице той нити, которую синтезировал IEP путем
обратной транскрипции. В результате в геноме хозяйской клетки
появляется новая копия интрона группы II.
 Thermosynechococcus elongatus. Фото с сайта www.wired.com Thermosynechococcus elongatus. Фото с сайта www.wired.com
Предполагается, что древние эукариоты «заразились»
интронами группы II от своих симбионтов — бактерий, которые стали
предками митохондрий. В ядерных геномах эукариот интроны группы II
чрезвычайно размножились и превратились в «обычные» сплайсосомные интроны. При
этом обратно-транскриптазная активность была ими утрачена. Функциональные части
интронов группы II, необходимые для сплайсинга, были выведены из их
состава и дали начало так называемым малым ядерным РНК (small nuclear RNA, snRNA),
которые представляют собой важнейшую составную часть сплайсосом. Другие интроны
группы II, сохранившие в своем составе гены обратных транскриптаз,
вероятно, дали начало одному из классов эукариотических ретротранспозонов
(non-LTR-retrotransposons).
В этой красивой теории есть одна неясная деталь.
В геномах большинства бактерий присутствует очень мало интронов
группы II, часто лишь один-единственный. Их размножение в
бактериальных геномах на самом деле сильно затруднено. Бактериальные
клетки этому активно сопротивляются, разрушая РНК интронов при помощи
ферментов-нуклеаз. Кроме того, отбор быстро закрепляет любые мутации, лишающие
интрон активности, потому что размножение интронов группы II в общем
случае вредно для хозяина. Как же удалось этим мобильным элементам так
расплодиться в ядерных геномах эукариот?
В поисках ответа на этот вопрос биологи из Техасского университета в Остине обратили
внимание на термофильную цианобактерию Thermosynechococcus elongatus, обитающую
в горячих источниках. Это единственная бактерия, в геноме которой
обнаружено много — целых 28 — интронов группы II. Сходство
нуклеотидных последовательностей этих 28 интронов привело авторов к выводу
об их едином происхождении. Иными словами, все они являются потомками одного
мобильного элемента, которым когда-то заразились предки T. elongatus.
Это значит, что, в отличие от других бактерий, в геноме T. elongatus интронам
группы II почему-то удалось неплохо размножиться. Авторы рассудили, что
выяснение причин этого обстоятельства поможет разобраться в происхождении
эукариотических интронов.
Оказалось, что из 28 интронов T. elongatus три
совсем деградировали под грузом мутаций, 17 содержат действующий рибозим,
но лишены рабочего гена IEP, а 8 интронов содержат оба функциональных
блока в исправном состоянии. Нуклеотидные последовательности любых двух
интронов T. elongatus совпадают не менее чем на 85%. Среди
известных бактериальных интронов самый похожий обнаружился у кишечной палочки E. coli (его
сходство с интронамиT. elongatus — около 50%).
Детальный анализ 17 интронов, лишенных
гена IEP, показал, что все они происходят от одного предкового интрона,
который сначала потерял IEP, а уже потом размножился в 17 копиях. Как
он мог размножиться, не имея необходимого гена? Очевидно, ему помогли
белки IEP, кодируемые другими, целыми интронами. Это важный вывод,
показывающий, что белок IEP способен размножать не только «свой» интрон,
но и другие похожие участки ДНК. Поэтому для успешного размножения интрону не
обязательно иметь свой собственный IEP.
Более того, интроны, не имеющие своего IEP,
размножаются даже эффективнее, чем «целые» интроны. Об этом
свидетельствует повышенное число копий таких укороченных интронов
по сравнению с целыми (17 против 8). Успешному размножению, вероятно,
способствует их компактность, которая делает их более трудной добычей для
бактериальных нуклеаз.
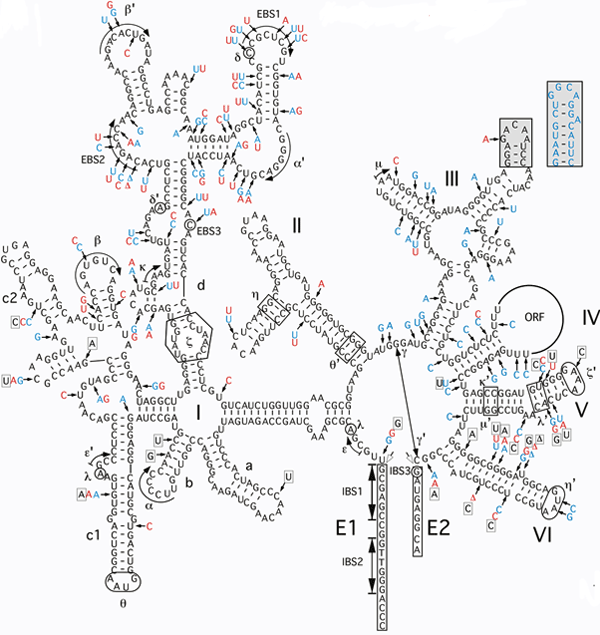
Вторичная структура одного из интронов T. elongatus. Буквами ORF обозначена петля, содержащая ген белка IEP (последовательность нуклеотидов в нём не показана). E1 и E2 — прилегающие к интрону участки экзонов. Двумя белыми стрелочками (над участками E1 и E2) показаны места сплайсинга. Здесь РНК разрезается, после чего экзоны E1 и E2 сшиваются друг с другом. EBS (exon-binding site) — участки интрона, от которых зависит, в какие места ДНК может встроиться интрон. Это определяется комплементарностью участков EBS и IBS (intron-binding sites). В данном случае участок EBS1 содержит последовательность CGCUCG, которая комплементарна последовательности IBS1 (GCGAGC) экзона E1. Дополнительными буквами и стрелочками сбоку от основной последовательности показаны отличия данного интрона от других интронов T. elongatus. Рис. из обсуждаемой статьи в PLoS Biology Авторы изучили активность интронов T. elongatus при
помощи генно-инженерных экспериментов на классическом лабораторном
объекте — кишечной палочке E. coli. В кишечную палочку
пересаживали фрагмент ДНК, кодирующий рибозимную часть интрона, отдельно
добавляли ген IEP и подходящий для встраивания данного интрона участок ДНК
(копию сшитых вместе участков E1 и E2, см. рисунок). Этот участок помещали
перед геном устойчивости к тетрациклину, который должен был активизироваться
только в том случае, если размножение интрона и его встраивание пройдет успешно.
В результате по количеству клеток, у которых появилась устойчивость к
тетрациклину, можно было определить эффективность размножения интрона.
Эксперименты дали весьма любопытные результаты.
Во-первых, оказалось, что интроны T. elongatus действительно
активны, то есть сохранили способность размножаться и встраивать свои копии в
ДНК хозяйской клетки.
Во-вторых, оба компонента интронов — и рибозим, и
белок IEP — оказались термофильными, то есть теплолюбивыми. Интроны
размножались гораздо лучше при 48°C,
чем при 37°C.
В-третьих, подтвердилось предположение о том, что
белки IEP способны размножать не только «свой» интрон, но и другие интроны,
в том числе лишенные собственного гена IEP. Из семи белков IEP некоторые
являются высоко избирательными: они размножают «свой» интрон гораздо лучше всех
остальных. Другие, однако, оказались менее разборчивыми и размножали разные
интроны примерно с одинаковой эффективностью.
В четвертых, было показано, что у всех интронов T. elongatus способность
к размножению сильно ослаблена из-за различных мутаций. Мутации, ослабляющие
активность интронов, нашлись как в рибозимах, так и в генах IEP. Современные
методы анализа структуры белков и рибозимов позволили авторам найти эти мутации
и «исправить» их. Это привело в ряде случаев к стопроцентной
размножаемости: «улучшенные» интроны встроились в подготовленный для них
участок ДНК в 100% модифицированных клеток E. coli.
В ходе дальнейших экспериментов авторы случайным
образом меняли последовательность нуклеотидов в участке, предназначенном
для встраивания интрона, чтобы определить, насколько интроны избирательны
в этом отношении. Выяснилось, что их избирательность не очень высока. Для
успешного встраивания интрона в данную позицию (сайт) на ДНК лишь очень
небольшое число нуклеотидов в этом сайте (иногда не более двух-трех) должны
быть строго определенными и стоять в строго определенных местах. С этими
нуклеотидами связываются по принципу комплементарности участки РНК
интрона, обозначенные на рисунке буквами EBS (exon binding site). Эти участки у
разных интронов разные, поэтому и встраиваются они в разные сайты. От строения
белка IEP избирательность интронов, как выяснилось, почти не зависит.
Самое интересное, что «привередливость» интронов
по отношению к сайтам встраивания снижается по мере роста температуры.
Как выяснилось, высокая температура не только активизирует размножение
интронов, но и позволяет им встраиваться в большее число разных точек на
хозяйской ДНК. Скорее всего, это связано с тем, что при высокой температуре
двойная цепь ДНК легче расплетается. Встраивание интрона начинается с того, что
белок IEP находит (при помощи рибозима) подходящий сайт на ДНК, расплетает
двойную спираль, а уже после этого рибозим своими EBS-участками
присоединяется к одной из нитей ДНК.
Таким образом, авторы выявили три основных фактора,
которые могли способствовать успешному размножению интронов группы II
в геноме T. elongatus:
1) Высокая температура, облегчающая расплетание
двойной спирали ДНК. Этим, по-видимому, объясняется тот факт, что единственной
бактерией, в чьем геноме интронам группы II удалось размножиться,
оказался термофильный T. elongatus.
2) Благодаря мутациям в EBS-участках интроны T. elongatus приобрели
способность встраиваться в разные участки хозяйской ДНК. По этому признаку
авторы смогли разделить 28 интронов на 6 «семейств». По-видимому,
изменения EBS-участков не сильно сказываются на эффективности сплайсинга. Это
значит, что интроны могут относительно свободно осваивать новые типы сайтов, и
поэтому их размножение не может быть остановлено «насыщением» всех подходящих
сайтов.
3) Некоторые белки IEP в ходе эволюции приобрели
способность размножать не только «свои» интроны, но и «чужие». Это открывает
возможность для быстрого размножения упрощенных, компактных интронов,
утративших ген IEP и ставших менее уязвимыми для нуклеаз, при помощи
которых хозяйская клетка пытается бороться с ними. Размножение таких упрощенных
интронов, не способных своими собственными силами осуществить сплайсинг,
создает предпосылки для формирования единой универсальной системы
сплайсинга — что, очевидно, и произошло при превращении интронов
группы II в сплайсосомные интроны эукариот.
Полученные результаты в целом хорошо согласуются
с гипотезой о происхождении сплайсосомных интронов и сплайсосом от интронов
группы II. Стало ясно, что при определенных условиях, особенно при высокой
температуре, бактериальные интроны группы II могут размножаться очень
быстро и встраиваться в разнообразные участки хозяйской ДНК. 2–3 миллиарда
лет назад, когда появились первые эукариоты, климат на планете, скорее всего,
был существенно теплее, чем теперь (см.: Экспериментальные белки
помогают узнать о климате древнейших эпох, «Элементы», 09.02.2008). Поэтому
предположение о том, что интроны группы II могли стремительно расплодиться
в ядерном геноме первых эукариот, стало выглядеть значительно более
правдоподобным. Кроме того, исследование показало, что у интронов
группы II различные функции (сплайсинг, встраивание, обратная транскрипция)
вполне отделимы друг от друга и не обязательно должны выполняться компонентами
одного и того же интрона. Такая «диссоциабельность» (разделимость) и
взаимозаменимость частей должна была существенно облегчить превращение одних
интронов группы II в сплайсосомные интроны и сплайсосомы, а других —
в эукариотические ретротранспозоны.
Помимо всего прочего, открытые авторами термофильные
мобильные элементы и обратные транскриптазы могут найти целый ряд полезных
применений в биотехнологии. Они могут пригодиться не только для
генно-инженерных манипуляций с термофильными микробами, но и для разработки
новых методов секвенирования РНК (см.: Reverse transcription polymerase chain reaction).
Источник: Georg Mohr, Eman Ghanem, Alan M. Lambowitz. Mechanisms Used for Genomic Proliferation by Thermophilic Group II Introns // PLoS Biology 8(6): e1000391. |