Германские биохимики обнаружили у некоторых
микробов необычный фермент с двойной функцией, участвующий в синтезе глюкозы.
Свойства фермента и положение его обладателей на эволюционном дереве
согласуются с гипотезой о том, что жизнь зародилась в горячих вулканических
источниках, а первые живые организмы были хемоавтотрофами, то есть
получали энергию из простых окислительно-восстановительных реакций и
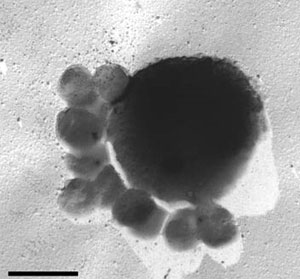
самостоятельно производили органику из CO2. Крупная клетка термофильной археи Ignicoccus hospitalis с облепившими ее мелкими клетками паразитической археи Nanoarchaeum equitans. Длина масштабной линейки 1 мкм. Фото с сайта www.astronomie.de
Предположение о том, что колыбелью жизни могли быть
горячие вулканические источники, в последнее время получило ряд
подтверждений. В присутствии соединений железа, никеля и серы в горячих
вулканических водах может происходить автокаталитическая фиксация углерода
(синтез органики из CO2или CO). Среди архей и наиболее древних
(«рано ответвившихся») групп бактерий много термофилов — жителей горячих источников, которые
самостоятельно фиксируют углерод и получают необходимую для жизни энергию из
окислительно-восстановительных реакций, протекающих в бескислородных условиях.
В качестве донора электрона эти микробы часто используют молекулярный
водород или угарный газ, в качестве окислителя — углекислый газ или
соединения серы. Многие авторы считают, что обмен веществ у таких
микроорганизмов крайне архаичен и может служить моделью для понимания
древнейших этапов эволюции жизни (Martin et al., 2008. Hydrothermal
vents and the origin of life; Wächtershäuser, 2006. Origin
of Life: RNA World versus Autocatalytic Anabolism; Гидротермальные источники —
колыбель жизни на Земле?, «Элементы», 30.10.2006).
Фиксация CO2 у автотрофных организмов
приводит к образованию трёхуглеродных молекул, таких как фосфоенолпируват и
3-фосфоглицерат, из которых затем синтезируется глюкоза. Синтез глюкозы (глюконеогенез)
представляет собой, по сути дела, обращенный вспять гликолиз (см. рисунок).
В ходе гликолиза глюкоза расщепляется на трёхуглеродные молекулы, а
выделяющаяся при этом энергия запасается в виде АТФ. В ходе
глюконеогенеза, наоборот, энергия расходуется и происходит синтез глюкозы из
трёхуглеродных молекул. Все реакции, изображенные на рисунке стрелками,
являются в принципе обратимыми. Некоторые из них катализируются одним и
тем же ферментом в обе стороны, другие требуют для этого разных ферментов.
Реакция, помеченная на рисунке цифрой 4, относится к первому типу,
реакция 3 — ко второму. 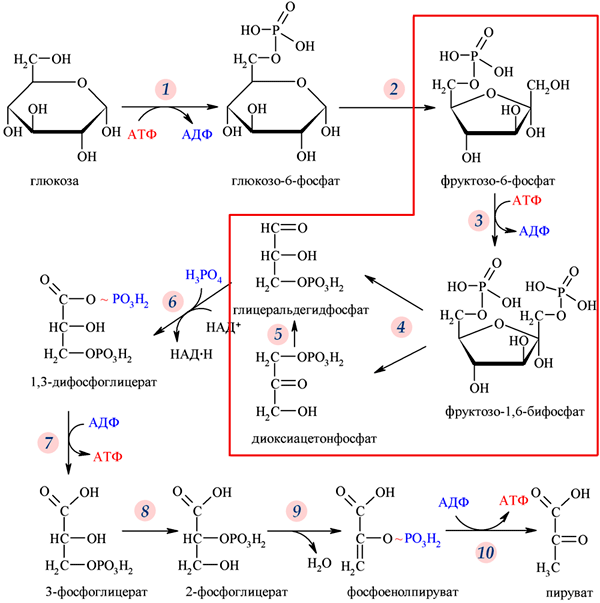
Гликолиз (путь Эмбдена–Мейергофа–Парнаса) — биохимический путь расщепления глюкозы, характерный для большинства живых организмов. Красной рамкой обведены промежуточные вещества и реакции, о которых идет речь в обсуждаемой статье в Nature. Рис. с сайта ru.wikipedia.org Вопрос о том, что появилось раньше — гликолиз или
глюконеогенез, — важен для понимания ранних этапов развития жизни. Если
первые живые существа были гетеротрофами и
питались абиогенно синтезированной органикой («первичным бульоном»), логично
предположить, что гликолиз древнее глюконеогенеза. Если первые организмы были
автотрофами, ситуация должна быть обратной.
У большинства организмов имеется именно тот вариант
гликолиза, который показан на рисунке (он называется «путь
Эмбдена–Мейергофа–Парнаса»), но у архей, которых многие считают самыми
примитивными (архаичными) живыми существами, наблюдается большое разнообразие
гликолитических путей и ферментов. Многие археи используют для расщепления
глюкозы менее эффективные «обходные» пути (см.: Entner–Doudoroff pathway), при которых не образуется
фруктозо-1,6-бисфосфат (FBP) и другие промежуточные соединения, характерные для
классического гликолиза. Между тем глюконеогенез у архей, по-видимому, идет
обычным, «классическим» путем (как на рисунке, только в обратную сторону).
Сторонники хемоавтотрофной теории происхождения жизни усматривают в этом
аргумент в пользу большей древности глюконеогенеза по сравнению с гликолизом.
Впрочем, до сих пор было не совсем ясно, каким образом
вообще осуществляется глюконеогенез у архей, потому что в их геномах
отсутствует ген одного из ключевых ферментов этого процесса — FBP-альдолазы.
Этот фермент катализирует реакцию, обозначенную на рисунке цифрой 4:
обратимое превращение глицеральдегидфосфата и диоксиацетонфосфата в FBP. FBP-альдолаза
ускоряет как прямую, так и обратную реакцию. Поэтому она необходима и для
гликолиза, и для глюконеогенеза.
Несмотря на отсутствие FBP-альдолазы, данная реакция у
архей все-таки происходит. Правда, идет она обычно только в одну сторону —
от трёхуглеродных молекул к FBP (что характерно для глюконеогенеза). Биохимики
из Фрайбургского университета (Германия) решили выяснить, что же катализирует
эту реакцию у термофильных архей, если у них нет FBP-альдолазы. Опыты
проводились с археями Ignicoccus hospitalis, Metallosphaera sedula и Thermoproteus
neutrophilus, которые живут при температуре 65–85°C.
Результат оказался неожиданным. Выяснилось, что
функцию FBP-альдолазы у этих архей выполняет другой фермент, который
до сих пор был известен как «архейная FBP-фосфатаза типа IV». FBP-фосфатазы есть
у большинства живых существ. Они катализируют следующий шаг
глюконеогенеза — превращение FBP в фруктозо-6-фосфат (реакция 3 на
рисунке). В свете новых данных архейный фермент пришлось переименовать в
«FBP-альдолазу/фосфатазу». Интересно, что ранее этот фермент довольно тщательно
изучался, была расшифрована даже его трехмерная кристаллическая структура. При
этом одна из двух его функций до сих пор ускользала от внимания
исследователей. 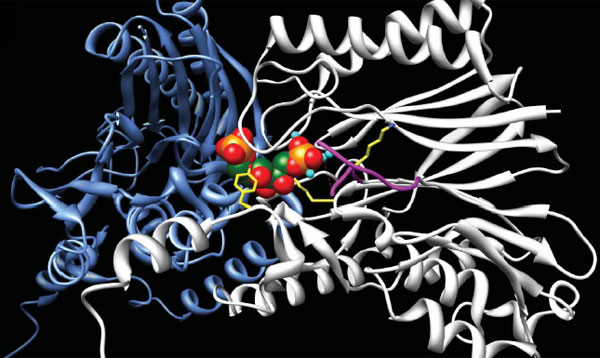
Трехмерная структура двух молекул FBP-альдолазы/фосфатазы в рабочем положении. Конструкция из цветных шариков в центре изображает молекулу субстрата (фруктозо-1,6,-бисфосфата, FBP). Рисунок из обсуждаемой статьи в Nature Благодаря совмещению в одном ферменте двух функций
FBP-альдолаза/фосфатаза быстро превращает свои субстраты (трёхуглеродные
глицеральдегидфосфат и диоксиацетонфосфат) сначала в FBP, а затем сразу в
стабильную молекулу фруктозо-6-фосфата. Это делает процесс практически
необратимым: у FBP не остается шансов распасться обратно на две
трёхуглеродные молекулы. Такой ускоренный и однонаправленный ход глюконеогенеза
можно рассматривать как адаптацию к высоким температурам. Дело в том, что
трёхуглеродные субстраты, образующиеся в результате фиксации CO2,
при высоких температурах неустойчивы: их «период полураспада» при 80°C составляет около четырех
минут. Быстрое их превращение в устойчивый фруктозо-6-фосфат позволяет
эффективно осуществлять глюконеогенез в горячей воде вулканических источников.
Авторы проанализировали известные на сегодняшний день
геномы архей и бактерий и обнаружили, что FBP-альдолаза/фосфатаза имеется у
большинства архей, а также у многих бактерий, относящихся к наиболее
архаичным эволюционным линиям. Распределение микробов, имеющих этот фермент, на
эволюционном дереве свидетельствует в пользу большой древности
FBP-альдолазы/фосфатазы. По-видимому, этот фермент появился существенно раньше,
чем многие ферменты классического гликолиза.
Среди микробов, имеющих FBP-альдолазу/фосфатазу,
многие являются термофилами — обитателями горячих источников, но есть
среди них и мезофилы, предпочитающие более низкие температуры. Авторы выделили
фермент из нескольких бактерий и архей и изучили его свойства при разных
температурах. Оказалось, что даже у холодолюбивых микробов данный фермент
обладает повышенной термоустойчивостью. Например, FBP-альдолаза/фосфатаза археиCenarchaeum
symbiosum (симбионта морской губки) отлично работает при 70°C. Это говорит о том, что
данный фермент, скорее всего, впервые возник у термофильных микробов, а
впоследствии некоторые его обладатели приспособились к жизни в более прохладной
среде.
По мнению авторов, свойства FBP-альдолазы/фосфатазы и
ее распределение на эволюционном дереве хорошо согласуются с хемоавтотрофной
теорией происхождения жизни. Хемоавтотрофы могли себе позволить необратимый
глюконеогенез, потому что глюкоза для них, как правило, не является важным
источником энергии и используется в основном для различных второстепенных нужд.
Незначительная роль углеводного обмена в энергетическом метаболизме характерна
для большинства архей, чем они резко отличаются от многих бактерий и всех
высших организмов. Для утилизации глюкозы в разных эволюционных линиях
архей впоследствии независимо развились различные «альтернативные» варианты
гликолиза.
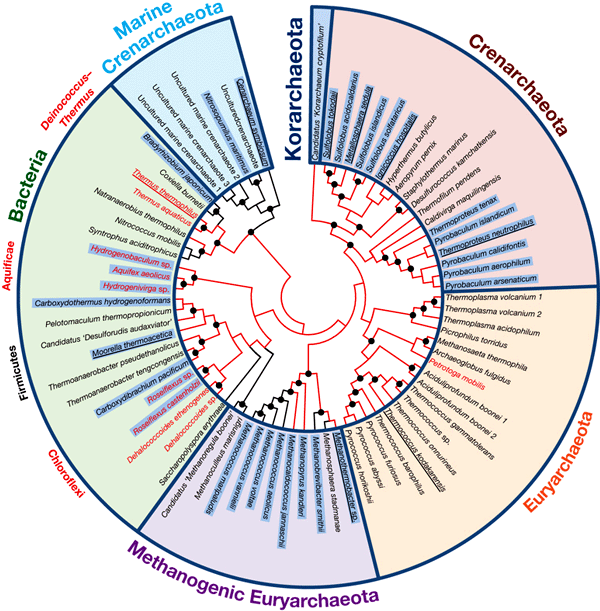
Эволюционное дерево FBP-альдолаз/фосфатаз. Подчеркнуты названия архей и бактерий, из которых фермент был выделен и экспериментально исследован (для остальных видов присутствие фермента установлено на основе анализа генома). Красные ветви дерева соответствуют термофилам. Дерево, основанное на FBP-альдолазах/фосфатазах, в общих чертах совпадает с эволюционными реконструкциями, основанными на множестве других генов. Это говорит о том, что горизонтальный обмен генами FBP-альдолаз/фосфатаз между неродственными группами микробов происходил не слишком часто. Рис. из обсуждаемой статьи в Nature На основе полученных результатов авторы предполагают,
что термоустойчивая FBP-альдолаза/фосфатаза появилась у древнейших автотрофных
микроорганизмов, зародившихся в горячих вулканических источниках. Приобретение
этого фермента было непосредственно связано с появлением глюконеогенеза —
биохимического пути синтеза глюкозы из трёхуглеродных продуктов
фиксации CO2. Археи и примитивные бактерии, возможно,
унаследовали этот фермент от общего предка. Не исключено, что некоторые
бактерии позаимствовали его от архей путем горизонтального переноса.
Классический гликолиз, представляющий собой обращенный вспять глюконеогенез,
появился гораздо позже. Возможно, это было связано с появлением эффективных
фотосинтетиков (таких как цианобактерии), которые впервые стали производить
глюкозу в «промышленных» количествах, что создало предпосылки для бурного
развития гетеротрофов (потребителей готовой органики).
Еще одно интересное свойство новооткрытого
фермента — удивительная легкость, с которой можно отключить одну из
его функций, оставив в целости вторую. Авторы экспериментировали с белком,
выделенным из уже упоминавшейся морской археи Cenarchaeum symbiosum. Оказалось,
что если заменить в активном центре фермента одну-единственную аминокислоту
(вместо лизина в 232-й позиции поставить аргинин), то фермент полностью теряет
свою FBP-альдолазную активность. FBP-фосфатазная активность при этом не только
сохраняется, но даже усиливается. Замена другой ключевой аминокислоты (тирозина
в 348-й позиции фенилаланином) дала обратный результат: альдолазная активность
сохранилась, а фосфатазная исчезла.
Помимо теоретического значения для понимания ранних
этапов эволюции, новый фермент может пригодиться в биоинженерии. При
определенных условиях он может обеспечить более эффективный синтез углеводов,
чем классические FBP-фосфатазы и FBP-альдолазы.
Источник: Rafael F. Say, Georg Fuchs. Fructose 1,6-bisphosphate aldolase/phosphatase may be an ancestral gluconeogenic enzyme // Nature. Advance online publication 28 March 2010.
|