Бактерии защищаются от вирусов, стараясь опознать паразитов еще до того, как те внедрят свою ДНК в клетку. Но если заражение всё же произошло, бактерии используют другой тип защиты; он обеспечивается присутствием в клетке особого локуса CRISPR. Фото с сайта www.hybridmedicalanimation.com В последние годы биологи активно исследуют недавно
открытый особый тип иммунитета у бактерий и архей. Иммунный ответ обеспечивают
специальные РНК, гены которых располагаются в особых локусах, получивших
название CRISPR. Эти РНК распознают чужеродную ДНК и помогают ее уничтожить.
Замечательно, что при внедрении нового вируса формируются новые соответствующие
гены в системе CRISPR у зараженной бактерии, и родительская клетка передает
приобретенный иммунитет по наследству. В системе CRISPR также имеется
встроенный механизм защиты собственной ДНК от аутоиммунного разрушения.
Иммунитет помогает
всем живым существам справляться с внедрением чужеродных агентов, в том
числе и паразитов. Иммунная система — это сложный биохимический аппарат;
у высших животных он нацелен на быстрое распознавание паразита и усиленное
производство антител, которые помогают его обезвредить. Важнейшее звено
иммунной машины позвоночных — выработка нужных, специфических,
антител — является остроумным изобретением природы: из миллионов имеющихся
лимфоцитов выбирается один или несколько таких, у которых поверхностные
белки оказываются комплементарными антигену внедрившегося паразита. Образование
комплекса антиген–антитело вызывает усиленное размножение именного этого типа
лимфоцитов, что и обеспечивает быструю иммунную реакцию.
Источником замечательного разнообразия лимфоцитов
служат неисчислимые комбинации нескольких коротких отрезков нуклеотидных
последовательностей, из которых в созревающем лимфоците собираются гены
антител. Таким образом, клетке не обязательно хранить отдельные гены для
каждого антитела, можно хранить набор заготовок, а затем, по мере
надобности, подбирать нужную комбинацию заготовок. Родители передают потомкам именно
наборы заготовок. Поэтому приобретенный за жизнь иммунитет не может
наследоваться, наследуется только возможность его приобрести. Так обстоят дела
у позвоночных животных.
У беспозвоночных животных и растений иммунитет
преимущественно врожденный (см. Иммунитет растений), а если и есть элементы приобретенного
иммунитета, то развивающиеся в течение жизни организма защитные средства
не передаются от родителей к потомкам — наследуется только способность их
вырабатывать. А вот бактерии и археи, как выяснилось в исследованиях
последних лет, способны передавать приобретенный иммунитет по наследству,
демонстрируя тем самым один из редких случаев настоящего «ламарковского»
наследования (см. Наследование приобретенных признаков).
В 2002 году началось планомерное изучение особых
участков (локусов) бактериального генома, которые представляют собой
расположенные группами короткие палиндромные повторы (CRISPR,
clustered regularly interspaced short palindromic repeats). Эти локусы найдены
у 90% архей и 40% бактерий.
Локусы CRISPR состоят из нескольких несоприкасающихся
палиндромных повторов, между которыми имеются промежутки — спейсеры.
Спейсер представляет собой короткий участок вирусной или плазмидной ДНК. Размер CRISPR-повтора исчисляется
23–47 нуклеотидными парами, а спейсеров — от 21 до
72 нуклеотидных пар. Число групп «повтор/спейсер» может
достигать 375, но обычно меньше 50. В бактериальном геноме может
быть не один, а несколько локусов CRISPR.
В непосредственной близости от CRISPR расположены гены
специальных белков, называемых Cas (CRISPR associated). Обычно Cas — это нуклеазы, полимеразы, нуклеотид-связывающие белки; всего эта группа
объединяет около 40 семейств белков.
Повторы CRISPR-последовательностей очень консервативны
в пределах каждого вида микробов, но сильно различаются от вида к виду.
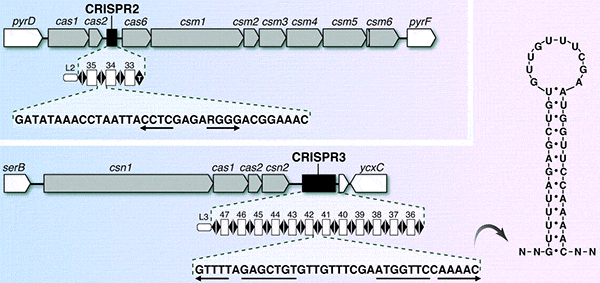
Схема двух локусов Streptococcus thermophilus, содержащих CRISPR и ассоциированные гены cas. Серым цветом показаны cas-гены, черным — CRISPR-последовательности. Под черными прямоугольниками вынесена подробная структура CRISPR. Черные ромбики — это палиндромные повторы, а белые маленькие прямоугольники — спейсеры, представляющие собой участки плазмидной или вирусной ДНК. Буквами внизу обозначены нуклеотидные последовательности палиндромных последовательностей, а петлеобразная структура справа изображает вторичную структуру РНК палиндромного повтора. Рисунок из обсуждаемой статьи в Science В 2007 году было экспериментально показано, что
бактерия Streptococcus thermophilus в ходе борьбы с
вирусами-бактериофагами изменяет последовательность CRISPR, достраивая к концу
старой последовательности еще одну или несколько единиц «повтор/спейсер».
Добавленные спейсеры были аналогичны участкам вирусного генома. При этом
бактерии приобретали устойчивость к данному вирусу. Если изменить
последовательность нуклеотидов добавленного спейсера или вообще вырезать
спейсер, то приобретенная устойчивость к фагу теряется.
В последующие два года ученые доказали, что локусы
CRISPR эволюционируют в ответ на вирусную активность, так что состав и
порядок расположения спейсеров указывает на историю различных вирусных атак.
Итак, взаимодействие с вирусами и чужеродными плазмидами приводит к появлению
иммунитета, который сохраняется в ряде поколений данного штамма. Ученые
предположили, каким может быть механизм приобретения и наследования иммунитета.
Во-первых, в формировании иммунитета участвуют
Сas-белки. Инактивация cas-генов ведет к снижению или потере способности
интегрировать в качестве спейсеров вирусную или плазмидную ДНК. Если в
клетку проникает чужеродная ДНК, то Сas-белки перво-наперво распознают ее.
Потом они же вырезают участок чужеродной ДНК и достраивают в локус CRISPR новую
рабочую единицу «повтор/спейсер». Обновленная бактериальная ДНК в дальнейшем
нормально дуплицируется и передается по наследству потомкам данной
бактерии. При транскрипции CRISPR формируется цепочка РНК (CRISPR-РНК, или
crРНК), которая затем нарезается на короткие кусочки, состоящие из двух половинок
палиндромного повтора и заключенного между ними спейсера. Эту нарезку также
осуществляют Сas-белки.
В результате получается внушительный набор коротких
crРНК с различными вирусными спейсерами. Среди них и тот, который был счастливо
приобретен при недавнем инфицировании. crРНК объединяются с некоторыми
Сas-белками. Если в такую клетку снова попадает этот вирус, то РНК, несущая
соответствующий спейсер, узнает комплементарный участок вирусной ДНК, а
Сas-белки обеспечивают инактивацию и избавление от паразитической ДНК. Само
собой разумеется, что узнавание чужеродной ДНК при помощи crРНК
осуществляется гораздо эффективнее и быстрее, чем исходное распознавание,
с которого началось формирование иммунитета.
Можно себе представить, что при частых атаках определенного
вируса соответствующая рабочая единица «повтор/спейсер» будет поддерживаться в
рабочем состоянии в ряде поколений (мутации, повреждающие ее, будут
отсеиваться отбором). Если же паразит оказался редким или экзотическим, то
соответствующая единица «повтор/спейсер» быстро накопит мутации, перестанет
работать или исчезнет вовсе. Так что CRISPR-иммунитет — это
самонастраивающаяся система. Взаимодействие между бактериями и вирусами
заставляет их геномы эволюционировать чрезвычайно быстро.
Совсем недавно американские ученые из Северо-Западного
университета (Эванстон, Иллинойс) открыли, как бактериям удается
избежать аутоиммунной реакции при функционировании crРНК. Гипотетически crРНК
должны бы распознать участок «родного» локуса CRISPR в бактериальной хромосоме
и деактивировать его. Но ведь этого не происходит. Оказалось, что в
распознавании чужеродных ДНК участвуют не только спейсеры, но и ограничивающие
спейсер фрагменты палиндромных повторов. Если при спаривании crРНК с ДНК
комплементарным оказывается не только спейсер, но и окружающие его нуклеотиды,
то crРНК узнает «родную» ДНК, и иммунная атака не происходит. Если же
спаривается только спейсер crРНК, то это означает чужеродную цепочку, и тогда
белки Cas избавляются от паразитической ДНК.
Источники: 1) Philippe Horvath, Rodolphe Barrangou. CRISPR/Cas, the Immune System of Bacteria and Archaea // Science. 2010. V. 327. P. 167–170. DOI: 10.1126/science.1179555.
2) Luciano A. Marraffini, Erik J. Sontheimer. Self versus non-self discrimination during CRISPR RNA-directed immunity //Nature. 13 January 2010. Doi: 10.1038/nature08703. |