Очень многие
нетребовательные микроорганизмы, например большинство псевдомонад, живущих в
почве и воде, а также Escherichia coli, хорошо растут на
среде, примерный состав которой приведен в табл. 6.1. Многим микроорганизмам,
однако, сверх того нужны еще какие-то из перечисленных выше микроэлементов,
витаминов или других добавок. Если питательный раствор составлен из
определенных химических соединений, то говорят о синтетической среде.
Исследователи стремятся определить для каждого микроорганизма минимальные
потребности в питательных веществах и составить минимальную среду, содержащую
лишь те ингредиенты, которые необходимы для роста. Более требовательные виды
нуждаются в большом числе добавочных веществ. Для Leuconostoc mesenteroides была
составлена синтетическая среда, содержащая более 40 компонентов. 
Сложные
среды. У многих особенно требовательных микроорганизмов потребности в
питательных веществах изучены пока недостаточно. Их культивируют на средах,
содержащих дрожжевой экстракт, дрожжевой автолизат, пептон или мясной экстракт.
Для выращивания ряда групп организмов используют также пивное сусло, сенной
отвар, сливовый или морковный сок, кокосовое молоко, а для копрофильных грибов -
даже выжимку из конского навоза. Для уменьшения стоимости к питательным
растворам часто добавляют вместо чистых соединений весьма сложные смеси, такие
как молочная сыворотка, патока, кукурузный настой или экстракт из соевых бобов -
дешевые отходы различных производств. Такого рода питательные среды называют
сложными.
Твердые
среды. Для приготовления твердых сред к жидким питательным растворам
добавляют особые вещества, которые придают им желеобразную консистенцию.
Желатину применяют для этой цели лишь в отдельных случаях, так как она имеет
слишком низкую точку плавления (26-30°С) и, кроме того, разжижается многими
микроорганизмами. Почти идеальным средством для получения твердых сред служит агар, который
Гессе, сотрудник Р. Коха, ввел в бактериологическую практику в 1883 г. Агар - полисахарид
сложного состава из морских водорослей, в сильной степени поперечносшитый. Его
добавляют к водным растворам в концентрации 15-20 г/л. Плавится агар только при
100°С, но при охлаждении остается жидким вплоть до 45°С. Разлагать его способны
лишь немногие бактерии. В тех случаях, когда требуются твердые среды, не
содержащие органических компонентов, применяют силикатель.
Концентрация
иоиов водорода. Ионы Н+ и ОН -
- наиболее подвижные из всех ионов, поэтому уже малейшие изменения их концентрации
оказывают на микроорганизмы сильное влияние. В связи с этим установление и
поддержание заданной оптимальной величины рН имеет существенное значение для
роста.
Большинство
организмов лучше всего растет, когда концентрации ионов Н + и
ОН - примерно одинаковы (рН 7). Многие бактерии, на пример
нитрифицирующие и клубеньковые бактерии, актиномицеты, бактерии, разлагающие
мочевину, предпочитают более высокие значения рН, т.е. слегка щелочные среды.
Лишь немногие толерантны к кислой среде (лактобациллы, Acetobacter, Sarcina ventriculi) или
даже ацидофильны (например, некоторые виды Thiobacillus). Грибы
предпочитают низкие значения рН. Если сложные питательные среды с различным рН
инокулировать почвой, то при рН 5,0 развиваются главным образом грибы, а при рН
8,0 - бактерии.
Поддержание
определенного рН во время роста важно прежде всего для тех микроорганизмов,
которые хотя и продуцируют кислоты, но не обладают к ним толерантностью
(лактобациллы, Enterobacteriaceae, многие псевдомонады). Для того чтобы
предотвратить гибель бактерий от ими же выделяемых кислот, используют либо
несбраживаемые вещества (при длительном культивировании), либо забуференные
среды. Определенное буферное действие (хотя и слабое при рН больше 7,2)
оказывают неорганические фосфаты. При более сильном выделении кислот
рекомендуется добавлять карбонат кальция или, если присутствие нерастворимых
компонентов в среде нежелательно, бикарбонат натрия. В последнем случае нужно
помнить о том, что ионы бикарбоната находятся в равновесии с двуокисью
углерода, растворенной в воде, а следовательно, и с СО2 в
газовой фазе (например, в воздухе):
Соотношение
между рН, концентрацией бикарбоната и парциальным давлением СО2 в
газовой фазе выражается уравнением Хендерсона-Хассельбальха; концентрация
угольной кислоты равна произведению парциального давления СО2 на
коэффициент растворимости а.
Впрочем,
многие бактерии сравнительно мало чувствительны к колебаниям рН в пределах от 6
до 9. Правда, при быстрых изменениях возможен кратковременный небольшой сдвиг
внутриклеточного рН, однако уже через 30 мин прежнее значение рН
восстанавливается.
Происходящие
при неблагоприятных значениях рН нарушения не связаны с прямым действием ионов
Н + и ОН -. Последние лишь снижают степень
диссоциации слабых кислот и оснований, которые в незаряженном состоянии
значительно легче проникают в клетки, чем продукты их диссоциации.
Физиологически активны всегда именно недиссоциированные кислоты. Двухосновная
янтарная кислота или трехосновная лимонная тем скорее проникает в клетку, чем
ниже рН среды.
Двуокись углерода. К питательному раствору,
предназначенному для выращивания автотрофных фиксирующих СО2 микроорганизмов,
обычно добавляют бикарбонат натрия и инкубируют культуры в закрытых сосудах в
атмосфере, содержащей СО2. Можно также продувать обычный или
обогащенный СО2воздух. Во всех случаях нужно учитывать указанную
выше зависимость между рН, концентрацией бикарбоната в среде и парциальным
давлением СО2 в газовой фазе.
Однако и
гетеротрофные (т.е. требующие органических источников углерода) микроорганизмы
обычно нуждаются в СО2. Многие паразитические бактерии, живущие в
крови, тканях или кишечнике, приспособлены к более высокому, чем в воздухе,
содержанию СО2. Эти бактерии культивируют поэтому в смеси газов или
в воздухе, обогащенном СО2 до 10 об. %. Кроме
того, следует учитывать, что удаление двуокиси углерода, например поглощение ее
гидроксидом калия, тормозит рост почти всех бактерий.
Содержание
воды и осмотическое давление. Микроорганизмы существенно различаются
по своей потребности в воде. Чтобы иметь возможность сравнивать водные растворы
и твердые материалы по содержанию в них доступной воды, пользуются такими
параметрами, как активность воды (aw) или относительная влажность.
Эти параметры относятся к фазе пара, находящегося в равновесии с твердым материалом
или с раствором. Это отношение концентрации воды в фазе пара в воздушном
пространстве над данным материалом к концентрации воды в воздухе над чистой
водой при определенной температуре.
Микроорганизмы
способны расти при активности воды от 0,998 до 0,6. В этом отношении наименьшие
потребности у осмотолерантных дрожжей Sacchawmyces rouxii, которые
растут при aw = 0,6%. Для Aspergillus glaucus и
других грибов нужны величины aw не ниже 0,8, а для большинства
бактерий - выше 0,98. Исключение составляют только галофильные бактерии,
которым достаточна активность воды 0,75.
Температура. К
температуре различные микроорганизмы относятся по-разному. Большинство
почвенных и водных бактерий мезофильны; температурный оптимум для их
роста лежит в пределах от 20 до 42°С. Термотолерантными являются
организмы, продолжающие расти и при 50°С (как, например, Methylococcuscapsulatus).
Термофильные бактерии быстрее всего растут при температурах выше
40°С, а верхний предел для них 70°С (Thermoactinomyces vulgaris, Bacillus stearothermophilus). Крайне
термофильными организмами называют те, у которых оптимум для роста выше
65°С (Thermus aquaticus, Sulfolobus).Некоторые из них
способны расти даже при температурах более 70°С (отдельные виды Bacillus иClostridium), более
80°С (Sulfolobus acidocaldarius) или даже при 105°С (Pyrodictium occultum
- строгий анаэроб, восстанавливающий серу). На другом конце температурной
шкалы находятся психрофильные (или криофильные) организмы;
это прежде всего некоторые морские светящиеся бактерии и железобактерии (Gallionella); максимальной
скорости их рост достигает при температурах ниже 20°С.
Аэрация. Всем
облигатным аэробам в качестве акцептора электронов необходим молекулярный
кислород. Для бактерий, растущих на агаре или в тонких слоях жидкости в
присутствии воздуха, кислорода обычно вполне достаточно. В жидких средах при
большом объеме жидкости аэробные бактерии могут расти только на поверхности,
так как в более глубоких слоях по мере удаления от поверхности условия
приближаются к анаэробным. Для нормального роста аэробных микроорганизмов в
глубоких слоях жидкой культуры требуется аэрация. Микроорганизмы способны
использовать только растворенный кислород. В то время как минеральные соли и
органические вещества можно добавлять к среде в концентрациях, обеспечивающих
рост бактерий на протяжении нескольких часов и даже дней, с молекулярным
кислородом этого cделать нельзя, так как растворимость его очень мала. Литр воды,
находящийся при 20°С в равновесии с атмосферным воздухом, содержит всего лишь
6,2 мл, или 0,28 ммоль, О2. Такого количества достаточно для
окисления не более 0,046 ммоль, или 8,3 мг, глюкозы (т.е. примерно одной
тысячной общего количества глюкозы, содержащегося в обычных питательных
средах). Поэтому в среде невозможно создать значительный запас О2 -кислород
приходится добавлять непрерывно. К счастью, микроорганизмы приспособились к
очень низким концентрациям растворенного кислорода; однако все же нельзя без
ущерба для дыхания клеток доводить эти концентрации до уровня ниже
критического.
Скорость
перехода молекулярного кислорода в раствор возрастает с увеличением поверхности
раздела между газовой и жидкой фазами и с повышением парциального давления О2 в
газовой фазе. Для аэрации жидких культур пользуются либо обычным воздухом, либо
смесью О2, N2 и СО2. Для увеличения
поверхности раздела прибегают к различным способам, таким как 1)
культивирование в тонком слое; 2) перемешивание жидкости путем встряхивания
(прямого или кругового); 3) вращение лежащих сосудов вокруг продольной оси; 4)
пропускание воздуха через жидкость под давлением с помощью газораспределителя
(стеклянные фильтры, колбы Клюйвера); 5) перколяция (рис. 6.1); 6) механическое
перемешивание. Для глубинной культуры аэробных микроорганизмов принудительную
аэрацию с помощью газораспределителей (стеклянных фильтров, дюз) часто
комбинируют с механическим перемешиванием. Весьма удобны такие аппараты, как
«ферментер без распределителя» и «система Вальдхофа», где при сильном
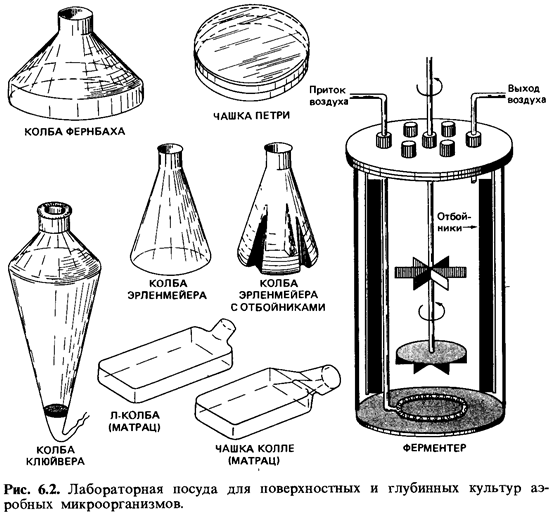
перемешивании образуется водоворот. На рис. 6.2 представлены различные сосуды,
форма которых рассчитана на максимальный контакт жидкости с воз духом, а также
некоторые лабораторные сосуды для глубинной культуры. 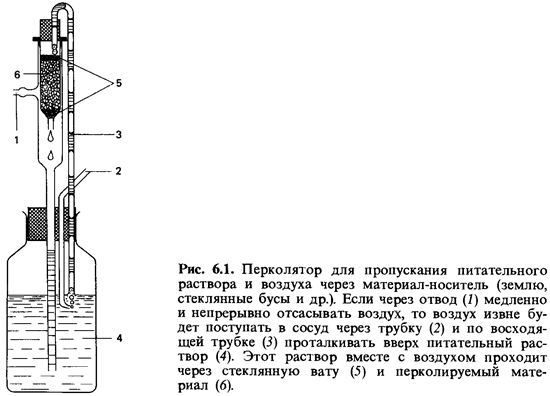
Следует
учитывать, что даже в хорошо аэрируемых ферментерах или в естественных водоемах
кислород не всегда бывает распределен равномерно. Если образуются скопления
бактерий, то возникают локальные стации с пониженным парциальным давлением О2.
Затравками для возникновения таких полуанаэробных микростаций служат
содержащиеся в природных водоемах взвешенные частицы. В эксперименте такие условия
можно воспроизводить, добавляя к бактериальным взвесям мелко дисперсные твердые
частицы (глину, целлюлозу, хитин). В этих случаях бактерии растут как «флора
обрастания» - очень плотно друг к другу на поверхности частицы так же страдают
от недостатка О2. Удобным объектом для демонстрации этого явления
могут служить факультативно-анаэробные бактерии, переходящие при недостатке О2 к
брожению(Escherichia coli) или нитратному дыханию (Pseudomonas denitrificans).
Анаэробные
культуры. При выращивании строго анаэробных бактерий необходимо
исключить доступ кислорода. Техника анаэробных культур предусматривает
применение прокипяченных питательных сред и сосудов, закрытых без пузырьков
воздуха; создание бескислородной атмосферы в вакуумных эксикаторах или горшках
Витта; применение адсорбентов кислорода (щелочного пирогаллола, дитионита,
хлорида одновалентной меди) и других вспомогательных средств. Нередко удается
ослабить или полностью нейтрализовать вредное для бактерий действие кислорода,
добавляя к среде восстановители (аскорбиновую кислоту, тиогликолат, цистеин или
даже сульфид, если бактерии его переносят).
Даже крайне
чувствительные к кислороду бактерии можно пересевать на воздухе, если путем
непрерывной продувки азота через культуральные сосуды исключить возможность
соприкосновения питательной среды с воздухом (техника Хангейта). Можно также
использовать перевивочные боксы, наполненные азотом, аргоном или водородом без
примеси О2. В качестве цветного индикатора анаэробных условий в
среду добавляют краситель резазурин (в присутствии О2 он синий,
в анаэробных условиях бесцветен) или ставят в анаэробные инкубационные склянки
сосудик с щелочным раствором глюкозы и метиленового синего (в анаэробных
условиях он бесцветен).
|







